
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Правила составления уравнений окислительно-восстановительных реакций
|
|
|
|
Вещества, содержащие элементы в промежуточной степени окисления – Н2SO3, HNO2, их соли, и др.
Классификация окислительно-восстановительных реакций
Наиболее обширную группу окислительно-восстановительных реакций составляют межмолекулярные реакции, протекающие с изменением степени окисления атомов в разных молекулах. Окислитель и восстановитель находятся в разных веществах; обмен электронами в этих реакциях происходит между различными атомами или молекулами:
2Mg0 + O20 = 2Mg+2O–2
2А10 + Fе2О3 = Al2+ЗO3 + 2Fe0
ЗМn+2SO4 + 2KMn+7O4 + 2Н2O = 5Mn+4O2 + 2KHSO4 + H2SO4
5KI–1 + KI+5O3 + 3H2SO4 = 3I20 + 3K2SO4 +3H2O.
При внутримолекулярных реакциях происходит изменение степени окисления атомов разных элементов в одной и той же молекуле. Обычно это реакции термического разложения веществ (AgNO3, ZrI4, КClO3 и др.), например:
2KCl+5O3-2 ® 2KCl-1 + 3O20
Cl+5 - окислитель; О-2 - восстановитель
N-3H4N+5O3 –t°® N2+1O + 2H2O
N+5 - окислитель; N-3 - восстановитель
2Pb(N+5O3-2)2 ® 2PbO + 4N+4O2 + O20
N+5 - окислитель; O-2 - восстановитель
(N-3H4)2Cr2+6O7 –t°® Cr2+3O3 + N20 + 4H2O
Cr+6 - окислитель; N-3 - восстановитель.
Диспропорционирование - окислительно-восстановительная реакция, в которой один элемент одновременно повышает и понижает степень окисления.
4KCl+5O3 = ЗКСl+7O4 + КСl–1
Cl20 + 2KOH ® KCl+1O + KCl-1 + H2O
3K2Mn+6O4 + 2H2O ® 2KMn+7O4 + Mn+4O2 + 4KOH
3HN+3O2 ® HN+5O3 + 2N+2O + H2O
2N+4O2 + 2KOH ® KN+5O3 + KN+3O2 + H2O.
Следует отметить, что многие реакции, которые, судя по записи уравнений, можно отнести к внутримолекулярным, в действительности протекают по более сложному механизму включающему межмолекулярное окисление-восстановление. Реакции самоокисления-самовосстановления реакции диспропорционирования (дисмутации) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Поэтому эти реакции принципиально осуществимы лишь для тех соединений, в молекулах которых есть атомы со степенью окисления, промежуточной между минимально и максимально возможной.
Внутримолекулярные реакции окисления-восстановления, в которых происходит выравнивание степеней окисления атомов одного и того же элемента, т. е. обратные ранее рассмотренным, называются процессами коммутации, компропорцонирования, контрдиспропорционирования.
2H2S-2 + H2S+4O3 ® 3S0 + 3H2O
В неорганической химии с такими процессами приходится встречаться реже, чем с реакциями диспропорционирования.
Естественно, что для записи уравнений окислительно-восстановительных реакций прежде всего надо знать состав продуктов реакции (часто они определяются на основании опыта). Для подбора стехиометрических коэффициентов в уравнении реакции необходимо определить, сколько электронов отдано восстановителем и сколько приобретено окислителем. Условно принято окисление отождествлять с отдачей электронов, а восстановление – с приобретением электронов, т. е. не принимается во внимание строение частиц, природа химической связи в них и механизм протекающего процесса.
Трактовка окислительно-восстановительного процесса как простой передачи электронов – это обычно лишь удобный прием, облегчающий написание уравнения реакции и подбор стехиометрических коэффициентов. Так, лишь формально можно считать, что в реакции
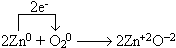
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 419; Нарушение авторских прав?; Мы поможем в написании вашей работы!