
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Направление протекания окислительно-восстановительных реакций в растворе
|
|
|
|
Происходит потеря атомом цинка двух электронов и приобретение их атомом кислорода, поскольку многозарядных одноатомных анионов, в частности свободных ионов О2–, вообще не может быть, тем более по соседству с катионом. В действительности связь между цинком и кислородом в молекуле ZnO полярная: по экспериментальным данным в этой молекуле эффективный заряд на атоме цинка примерно равен +1,2, т. е. почти вдвое меньше степени окисления +2.
Подбор коэффициентов в уравнениях окислительно-восстановительных реакций осуществляют, составляя электронный баланс. Метод подбора, сводящийся к подсчету количеств атомов в правой и левой частях уравнения, не всегда гарантирует правильное определение коэффициентов.
Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
Уравнение составляется в несколько стадий:
Fe0 + 2HCl = FeCl2 + H2 0↑
Определяются элементы и ионы, меняющие степень окисления, устанавливается окислитель и восстановитель, восстанавливается баланс, а затем по ионному уравнению восстанавливается молекулярное.
 1 Fe0 − 2ē = Fe+2
1 Fe0 − 2ē = Fe+2
1 2H+ + 2ē = H2

Fe0 + 2H+ = Fe+2 + H20↑.
Электронно-ионный баланс (метод полуреакций) - метод нахождения коэффициентов, в которомрассматривается обмен электронами между ионами в растворе с учетом характера среды. Так, при взаимодействии перманганата калия с соляной кислотой KMnO4 + HCl = KCl + MnCl2 + Cl2 + H2O записывается две полуракции.
Очевидно следующее. В сложных случаях электронно-ионный баланс помогает определить, что с чем реагирует и какие продукты при этом получаются. И позволяет определить коэффициенты уравнения реакции. Особенно эффективен метод электронно-ионных полуреакций в тех случаях, когда трудно или вообще невозможно определить степени окисления атомов в веществах - реагентах и/или продуктах реакции.
Процессы обмена электронов между окислителем и восстановителем происходят при непосредственном контакте между ионами. Но этот процесс можно разделить, передавая электроны от восстановителя к окислителю с помощью проводника. Ионные процессы в этом случае будут осуществляться за счет перемещения ионов с помощью ионопроводящей трубки. Эта трубка заполнена раствором электролита. Система, в которой осуществляется этот процесс называется гальваническим элементом (элемент Якоби):
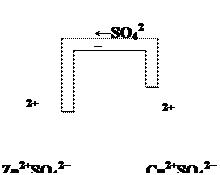
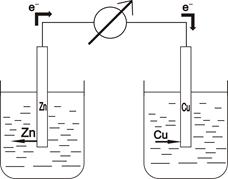
Схема элемента Даниэля–Якоби
CuSO4 + Zn0 = Cu0 + ZnSO4
Cu2+ + 2ē = Cu0 - окислитель Катод (К )
)
Zn0 - 2ē = Zn2+ - восстановитель Анод (А ).
).
Катод – это электрод, на котором идут процессы восстановления, на аноде – окисления. Например, в процессах окисления анод заряжен отрицательно, а в гальваническом элементе – положительно. Каждая из этих полуреакций характеризуется электродным потенциалом (Е0, φ). Электродный потенциал характеризует активность окислителя и восстановителя. Чем больше алгебраическая величина электродного потенциала реакции, тем большими окислительными свойствами он обладает. Эти потенциалы сводят в таблицы (чем ниже находится значение, тем большей величина потенциала является). Активность окислителя и восстановителя характеризуется величиной стандартного электродного потенциала. Стандартными условиями являются – 250 С и концентрация 1 моль/л. Для каждой окислительно-восстановительной реакции, зная потенциалы полуреакций, можно определить э.д.с. этой о.-в.-р. Для этого:
ЭДС = Е0ок-ля - Е0восст-ля.
Если ЭДС имеет положительное значение, то реакция может протекать слева направо. При отрицательном значении ЭДС реакция не идет в прямом направлении, но возможна обратная реакция.
Например. Определить возможность протекания реакции между ионами олова (II) и ионами железа (III).
Sn4+ + 2ē = Sn2+ Е01= + 0,15
Fe3+ + 1ē = Fe2+ Е02= + 0,77, а сами реакции:
Sn4+ + 2 Fe3+ = Sn2+ + 2 Fe2+ ЭДС = 0,15 – 0,77 = - 0,62 В
Sn2+ + 2 Fe2+ = Sn4+ + 2 Fe3+ ЭДС = 0,77 – 0,15 = 0,62 В.
Отсюда можно сделать вывод, что первая реакция слева направо не идет, а вторая может идти в прямом направлении.
В учебниках химии можно встретить уравнения с очень большими коэффициентами. Например:
4Zn + 10HNO3 ® 4Zn(NO3)2 + NH4NO3 + 3H2O (эта реакция идет с сильно разбавленной азотной кислотой, на экзаменах по химии экзаменаторы нередко требуют записать это уравнение и подобрать к нему коэффициенты);
18P + 20CuSO4 + 32H2O ® 8H3PO4 + 5Cu + 5Cu3P2 + 20H2SO4 (эту реакцию используют для нейтрализации белого фосфора) и т.д.
Все подобные реакции, без сомнения, сложные, идут в несколько стадий и не являются стехиометрическими. Так, цинк может восстанавливать азот в разбавленной азотной кислоте не только до степени окисления –3, но и частично до других степеней окисления.
«Рекордсменом» среди уравнений этого типа является реакция, предложенная много лет назад одним из сотрудников американского «Журнала химического образования» (Journal of Chemical Education) Л.С.Фостером. Он предложил Норрису Рэйкстроу, который в то время был главным редактором этого журнала, подобрать коэффициенты в уравнении такой реакции: [Cr(N2H4CO)6]4[Cr(CN)6] + MnO4– + H+ ® Cr2O72– + CO2 + NO3– + Mn2+ + H2O. В этой реакции перманганат окисляет сложное комплексное соединение, в котором хром образует комплексный катион с мочевиной и комплексный анион с цианидом. В ноябре 1943 это уравнение появилось на страницах журнала с таким сопровождением главного редактора: «Л.С.Фостер уверяет, что коэффициенты подобрать можно, хотя у него самого на это ушло времени на 1 доллар 27 центов, если считать на его современную почасовую оплату. Я хотел бы знать, кто сможет сделать это быстрее. Ждем писем!»
Редакция получила немало писем с решением, причем читателями были использованы все основные методы подбора коэффициентов: метод электронного баланса, метод ионных полуреакций и алгебраический метод. Рекордным было время 15 минут! (Кстати, сейчас простенькая компьютерная программа сделает это за ничтожные доли секунды.)
Итоговое уравнение имеет поистине чудовищные коэффициенты:
10[Cr(N2H4CO)6]4[Cr(CN)6] + 1176KMnO4 + 2798HNO3 ® 35K2Cr2O7 + 420CO2 + 1106KNO3 + 1176Mn(NO3)2 + 1879H2O.
Настоящий химический монстр! Нет сомнений, что эта реакция нестехиометрическая и ее коэффициенты лишь приближенно отражают соотношение реагентов и продуктов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 501; Нарушение авторских прав?; Мы поможем в написании вашей работы!