
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Координационная теория комплексных соединений
|
|
|
|
Вычисление смешанного произведения в декартовых координатах.
Теорема. Если в декартовой прямоугольной системе координат
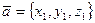 ,
, 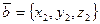 ,
, 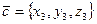 ,
,
то
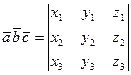 .
.
Доказательство. По определению смешанного произведения
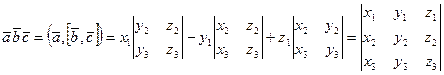 .
.
Теорема доказана.
Задача. Для любых трех векторов 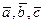 можно определить двойное векторное произведение
можно определить двойное векторное произведение 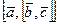 . Докажите, что
. Докажите, что 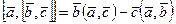 .
.
К концу Х1Хв. был накоплен огромный материал о свойствах комплексных соединений, однако их строение и состав не удавалось объяснить с позиций классической теории валентности.
Основатель координационной теории А.Вернер (1893г.) предположил, что в отличие от обычных веществ в комплексных соединениях элементы проявляют, кроме главной валентности, еще и дополнительную, побочную. Благодаря действию сил именно побочной валентности происходит процесс комплексообразования. Но в самом комплексе различие между главной и побочной валентностями исчезает, все связи становятся равноценными, их называют координационными.
Вернер подчеркнул, что действие побочной валентности вызывает укрепление связей между атомами. Например, соединение PbCl4 чрезвычайно неустойчиво, а комплексное соединение K2[PbCl6], образование за счет побочной валентности свинца(+2), – довольно прочное. Таким образом, в комплексных соединениях наблюдается стабилизация как высших, так и низших валентных форм элемента.
В современном виде координационная теория А.Вернера, которая постоянно углубляется и дополняется, сводится к нескольким основным положениям.
1 В молекуле комплексного соединения атом (ион), который за счет главной и побочной валентностей координирует вокруг себя определенное количество нейтральных молекул или противоположно заряженных ионов, называется центральным атомом, или комплексообразователем.
Наиболее часто в роли комплексообразователя выступают положительно заряженные ионы (реже – атомы) d- и р-металлов, иногда – щелочноземельных и даже щелочных металлов, а также неметаллов (В, Si, P, As).
2 С центральным атомом непосредственно соединяются молекулы или ионы, которые называются координированными группами, аддендами, или лигандам
3 Комплексообразователь совместно с лигандами составляет и. внутреннюю сферу комплексного соединения, или просто комплекс, который при написании координационной формулы берется в квадратные скобки, чтобы подчеркнуть его монолитность: К3[Fe(CN)6], Na[BF4].
Заряд внутренней сферы определяется алгебраической суммой степени окисления комплексообразователя и совместных зарядов всех лигандов:
+2 – 4– +3 0 3+ +4 0 0 – 2+
[Fe(CN)6], [Cr(H2O)6], [Pt(NH3)3(H2O)(OH)2].
4 Если степень окисления комплексообразователя по абсолютной величине не равна сумме зарядов всех лигандов, то комплексное соединение содержит внешнюю сферу, которую записывают вне квадратных скобок: [Ag(CN)2] Cl, K [Ag(NH3)2]. Однако существуют и нейтральные комплексы, лишенные внешней сферы, их иногда называют комплексными неэлектролитами:
+2 – 0 0 0 0 0 0 0 0 +3 – 0 0
[PtCl2(NH3)2], [Fe(CO)5], [Ca(NH3)6], [CrCl3(H2O)3].
5 Общее количество координационных валентностей, с помощью которых комплексообразователь во внутренней сфере связан с лигандами, называется координационным числом (к.ч.).
Известны координационные числа от 1 до 9 и 12. Наиболее распространенными являются комплексные соединения с координационными валентностями 2, 4 и 6. Довольно часто координационное число бывает вдвое большим, чем степень окисления комплексообразователя, например:
+1 +2 +3
[Ag(NH3) 2 ]+, [Zn(OH) 4 ]2–, [Co(NO2) 6 ]3–,
однако это нестрогая зависимость.
В общем случае координационное число может иметь переменную величину не только для разных комплексообразователей, но и для одного и того же, поскольку на количество координированных лигандов влияют определенные факторы:
· Заряд лиганда. Например, координационное число никеля (+2) с нейтральными
лигандами равно 6, а с отрицательно заряженными анионами CN–, между которыми действуют значительные силы отталкивания, – только 4:
+2 +2
[Ni(NH3) 6 ]2+, [Ni(CN) 4 ]2–.
· Размеры лигандов. Комплексы, содержащие небольшие по размерам ионы, характеризуются б о льшими величинами координационных чисел, например, для фторсодержащих алюминатных комплексов координационное число больше, чем для хлор- и бромсодержащих, так как радиус фторид-иона намного меньше, чем радиусы ионов Cl- и Br-:
[AlF 6 ]3–, [AlCl 4 ]–, [AlBr 4 ]–.
· Природа внешней сферы. Например, в комплексном соединении [Cu(NH3) 4 ]SO4 медь(+2) имеет координационное число 4, но если изменить ион SO42– на более громоздкую внешнюю сферу, то координационное число может увеличиваться: [Cu(NH3) 6 ]3(PO4)2.
· Свойства растворителя, в котором происходит образование комплексного соединения. Так, в полярном растворителе – воде – легче возникают комплексы [Co(CNS) 1 ]+ и [Co(CNS) 2 ], а в малополярном – ацетоне – при одних и тех же условиях – [Co(CNS) 3 ]– и [Co(CNS) 4 ]2–.
· Концентрация реагирующих компонентов. При возрастании концентрации появляется тенденция к образованию более сложных комплексов. Например, в разбавленных растворах удается идентифицировать лишь комплекс [Fe(CNS) 1 ]2+, в то время, как с увеличением концентраций реагирующих веществ получаются более сложные комплексы: от [Fe(CNS) 3 ] вплоть до [Fe(CNS) 6 ]3–.
6 Разные лиганды могут занимать вокруг центрального атома разное количество
координационных мест.
Количество мест, которое занимает вокруг комплексообразователя отдельная
координированная группа, называется координационной емкостью лиганда.
Как правило, определенный лиганд проявляет постоянную координационную емкость, но для многозарядных лигандов она может быть переменной. Например, в соединении [Co(NH3)4SO4]Cl анион SO42– занимает два координационных места, а в [Co(NH3)4(H2O)SO4]Cl – только одно, поэтому и координационная емкость лиганда SO42– в этих соединениях равна соответственно 2 и 1.
По этой причине один и тот же комплексообразователь с разными лигандами при одинаковых условиях дает комплексы разного вида, например:
+3 +3 +3 +3
K3[Fe(CN) 6 ], K3[Fe(C2O4) 3 ], K3[Fe(PO4) 2 ], K3[Fe(ЭДТА) 1 ].
В зависимости от координационной емкости различают такие лиганды:
· Монодентантные, занимающие одно координационное место, например, анионы Cl–, CN–, Br–, F–, I– или нейтральные молекулы Н2О, NH3, CO.
· Бидентантные, которые занимают по два координационных места. К ним относятся некоторые органические соединения: гидразин NH2–NH2, аминоуксусная кислота NH2CH2–COOH, этилендиамин NH2–CH2–CH2–NH2, а также ионы SO42–, CO32–, C2O42– и прочие. Однако необходимо помнить, что эти ионы иногда могут соединяться с комплексообразователем лишь одной координационной связью, как было показано на примере соединения [Co(NH3)4(H2O)SO4]Cl.
· Полидентантные, которым присуща высокая координационная емкость (3-6). Одним из важнейших полидентантных лигандов является анион этилендиаминтетрауксусной кислоты (сокращенно обозначается ЭДТА), имеющий координационную емкость 6:
 В О
В О
С–СН2 СН2–С
<––– О– N–CH2–CH2–N O– –––>
<––– O– .... O– –––>.
C–CH2 ¯ ¯ CH2–C
O O
В структурной формуле ЭДТА стрелками показаны атомы, за счет которых образуется шесть связей с комплексообразователем.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1099; Нарушение авторских прав?; Мы поможем в написании вашей работы!