
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура
|
|
|
|
КЛАССИФИКАЦИЯ
Существует несколько классификаций комплексных соединений. В зависимости от признака, который принимают во внимание, одно и то же комплексное соединение можно отнести одновременно к разным видам.
1 По знаку заряда различают такие комплексные соединения:
· катионные, содержащие положительно заряженную внутреннюю сферу, например: [Ag(NH3)2] +, [Cr(H2O)6] 3+;
· анионные с отрицательно заряженной внутренней сферой, например: [Ag(CN)2] –, [Cr(OH)6] 3–;
· нейтральны е, которые лишены внешней сферы: [Ni(CO)4] 0, [Cr(H2O)3(OH)3] 0;
· бикомплексные, состоящие из комплексного аниона и комплексного катиона, например: [Co(NH3)6] 3+[ Fe(CN)6] 3–.
·
2 В зависимости от природы лигандов различают:
· аквакомплексы, во внутренней сфере которых имеются молекулы воды, например: [Cr(H2O)6]3+, [Cu(H2O)4]2+;
· аммиакаты, в которых лигандамы являются молекулы аммиака: [Cu(NH3)4]2+, [Ag(NH3)2]+;
· карбонилы, в которых в качестве лигандов содержатся молекулы оксида углерода(ІІ): [Fe(CO)5];
· гидроксокомплексы. Содержащие во внутренней сфере гидроксильные группы: [Zn(OH)4]2–, [Al(OH)6]3–;
· ацидокомплексы, в которых лигандами являются анионы разных кислот, в том числе оксалатные (С2О42–), галогенидные (F–, Cl–,Br–, I–), цианидные (CN–), сульфатные (SO42–), тиосульфатные (S2O32–), нитратные (NO3–), нитритные (NO2–) и т.п.;
· смешанные комплексы, во внутренней сфере которых размещаются лиганды разной природы: [Co(NH3)4Cl2].
3 По количеству ядер комплексы бывают:
· моноядерные, содержащие только один комплексообразователь: [Ag(NH3)2]+, [Fe(CN)6]4–;
· полиядерные, в которых имеется два или больше комплексообразователей.
Примером двуядерного комплекса может быть соединение состава
[(NH3)5 Cr –OH– Cr (NH3)5]Cl5,
в котором два комплексообразователя (Cr3+) соединяются через группу ОН. Эта связывающая группа называется мостиковой, в качестве которой могут функционировать частицы с неподеленными электронными парами: F–, Cl–, O2–, S2–, SO42–, NH2–, NH2– и прочие.
Полиядерные комплексы, в которых мостики образованы гидроксильными группами, называются оловыми. По структуре мостиковая гидроксильная группа отличается от лигандного гидроксила в одноядерных комплексах. В оловых комплексах координационное число кислорода в ОН-группе равно 3, поскольку атом кислорода одновременно связан с двумя комплексообразователями и одним атомом водорода.
Многоядерные комплексы еще недостаточно изучены, однако известно, что они могут содержать несколько мостиковых групп. Примером многоядерных комплексов являются поликислоты. Среди них различают изополикислоты, ядра которых образованы атомами одного элемента, и гетерокислоты, в которых мостиковый кислород соединяет ядра, образованные разными элементами:
H2[O3Cr-O-CrО3] – дихромовая кислота;
H2[-O-SiО2–…–SiO2–O–]– полиметакремниевая кислота;
H3[O3P-O-MoО3] – фосфорномолибденовая кислота.
Склонность к образованию поликислот проявляют некоторые неметаллы (В, Р, As, Si), а также d-металлы V и VI групп периодической системы.
К полиядерным комплексам относятся и кластерные соединения, в которых центральные атомы-ядра соединены между собою непосредственно: [(CO)5Mn–Mn(CO)5].
4 По геометрической структуре комплексные соединения разделяют на простые и циклические. В простых комплексах лиганды занимают одно координационное место, а полидентантные лиганды, соединенные несколькими связями с одним и тем же комплексообразователем, дают циклические комплексы, например, оксалатный комплекс железа (ІІІ) [Fe(C2O4)3]3–:
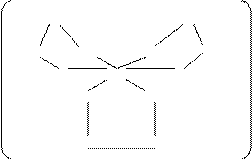 3–
3–
O=C C=O
O=C O O C=O
O Fe O
O O
O=C C=O
В соответствии с Международной номенклатурой IUPAC названия комплексных соединений образуют по определенным правилам.
1 Порядок перечисления ионов. В названии анионного комплексного соединения после перечисления лигандов приводится корень латинского названия комплексообразователя с добавлением окончания -ат и его степени окисления (римской цифрой в скобках), а потом раздельно – русское название катиона в родительном падеже. Например:
K2[Pb(OH)4] – гексагидроксоплюмб ат (IІ) калия,
Na2[Hg4] – тетрайодомеркур ат (II) натрия,
K3[Fe(CN)6] – гексацианоферр ат (III) калия.
В случае катионного комплексного соединения сначала называют анион в именительном падеже, далее – отдельным словом перечисляют лиганды, прибавляя русское название комплексообразователя в родительном падеже и его степень окисления:
[Pb(H2O)4](NO3)2 – нитрат тетраквасвинц а (II),
[Hg(NH3)4]Cl2 – хлорид тетраамминртут и (II),
[Fe(H2O)6]2(SO4)3 – сульфат гексакважелез а (III).
В названии нейтрального комплекса, которое записывается одним словом, после перечня лигандов приводят русское название комплексообразователя в именительном падеже и его степень окисления:
[Co(NH3)3Cl3] – трихлоротриамминкобальт(III),
[Fe(CO)5] – пентакарбонилжелезо(0),
[Pl(NH3)2Cl2] – дихлородиамминплатина(II).
2 Перечисление лигандов и их названия. Лиганды в комплексе пересчисляют без разделения их дефисом друг от друга в такой последовательности: анионные, нейтральные, катионные.
При названии анионных лигандов соблюдают следующий порядок: гидридо Н–, оксо О2-, гидроксо, потом в соответствии с алфавитом (не учитывая множительных префиксов „ди”, „три”, „тетра” и т.п.) – простые лиганды с добавлением окончания „о” (бромо Br-, йодо I-, хлоро Cl-), полиатомные анионы (нитрато NO–3, нитрито NO–2, оксалато C2O42-, сульфато SO42-, тиосульфато S2O32-, фосфато PO43-, циано CN-), органические анионы (аминоацетато NH2CH2COO-, этилендиамминтетраацетато ЭДТА, этилендиаммин En).
Нейтральные лиганды называют так: аква H2O, аммин NH3, карбонил CO, нитро NO2. Катионные лиганды встречаются чрезвычайно редко, поэтому здесь не рассматриваются. В примерах, приведенных ниже, анионные лиганды выделены жирным шрифтом, а нейтральные – курсивом:
K2[Pt(NO2)2Cl4] – ди нитрито тетра хлоро платинат(IV) калия,
K2[UO2Cl4] – ди оксо тетра хлоро уранат(VI) калия,
[PtClEn4]SO4 – сульфат хлоро тетраэ тилендиаммин платины(IV),
[Co(NH3)4Br(H2O)](NO3)2 – нитрат бромо аква тетра аммин кобальта(III),
[Co(NH3)6][Fe(CN)6] – гекса циано феррат(III) гекса аммин кобальта(III),
[Nd(H2O)9](BrО3)3 – бромат нон аква неодима(III).
3 Префиксы для обозначения количества лигандов. Для лигандов с простоянными названиями используют греческие числительные: ди-, три-, тетра–, пента-, гекса- и т.п. Например:
K2[ReH9] – нона гидридореннат(VII) калия,
K4[SnF8] – окта фторостаннат(IV) калия,
[Al(H2O)5(OH)]SO4 – сульфат гидроксо пента акваалюминия.
Если лиганд имеет сложное название, которое уже содержит эти числительные, то используют дополнительные префиксы „бис”, „трис”, „тетрис”. Например:
[Fe(En)3]Cl хлорид трис (этилен ди аммин) железа(III).
4 Названия мостиковых групп. Группы, соединяющие два центра координации, обозначают греческой буквой μ (мю):
K4[(C2O4)2Cr(OH)2Cr(C2O4)2] – ди- µ -гидроксотетраоксалатодихромат(III) калия.
5 Геометрические изомеры. Эту группу комплексных соединений называют, используя цифры или прибавляя префикс „цис” (в случае соседних положений одинаковых лигандов) или „транс”, если одинаковые лиганды размещаются с противоположных сторон относительно комплексообразователя:
Cl Cl
 | |||
 | |||
 NH3->Pd<-NH3 NH3->Pd<-Cl
NH3->Pd<-NH3 NH3->Pd<-Cl

Сl NH3
Транс-дихлордиаммин– Цис-дихлордиаммин–
палладий(II), (1,4-дихлор– палладий (ІІ) (1,2-дихлор–
диамминпалладий(II)) диамминпалладий (ІІ))
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1209; Нарушение авторских прав?; Мы поможем в написании вашей работы!