
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изомерия
|
|
|
|
СТОЙКОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
В разбавленных водных растворах большинство комплексных соединений подвергается практически полной первичной диссоциации на внутреннюю и внешнюю сферы. При этом образующийся комплексный ион ведет себя как единое целое:
[Ag(NH3)2]Cl à [Ag(NH3)2]+ + Cl–,
K[Ag(CN)2] àK+ + [Ag(CN)2]–.
Наряду с этим процессом в очень незначительной степени проходит вторичная диссоциация – разложение внутренней сферы комплекса на составные части:
[Ag(NH3)2]+ «Ag+ + 2NH3,
[Ag(CN)2]- «Ag+ + 2CN-.
Поскольку комплексный ион проявляет себя как весьма слабый электролит, вторичная диссоциация подчиняется закону действующих масс. Следовательно, можно записать выражение константы равновесия, которое в данном случае называется константой нестойкости комплексного иона:
[Ag+].[NH3]2
Кнест [Ag(NH3)2]+ = ---------------------- = 6 ×10-8,
[ [Ag(NH3)2]+]
[Ag+].[CN–]2
Кнест [Ag(СN)2]– = ------------------ = 10-22 .
[ [Ag(CN)2]–]
Константа нестойкости служит мерой прочности внутренней сферы: чем меньше величина Кнест, тем прочнее комплекс. Значит, из двух приведенных примеров большую устойчивость проявляет второй комплекс, так как ему отвечает меньшее значение константы нестойкости.
Иногда вместо константы нестойкости используют обратную ей величину – константу стойкости:
1 [ [Ag(NH3)2]+]
К уст = -------- = ----------------------- = 1,7×107,
К нест [Ag+] [NH3]2
1 [ [Ag(CN)2]- ]
K уст = ---------- = ------------------------ =1022.
K нест [Ag+] [CN-)]2
Большему значению константы стойкости отвечает большая концентрация комплексообразователя в растворе при состоянии равновесия.
Детальное изучение комплексных соединений доказало, что процесс вторичной диссоциации происходит ступенчато. Так, от комплексного иона [Ag(NH3)2]+ отрывается сначала одна молекула аммиака:
[Ag(NH3)2]+ «[Ag(NH3)]+ + NH3.
Равновесие первой ступени характеризуется константой
[ [Ag (NH3)]+].[NH3]
Кнест I = ---------------------------- = 6 × 10-4.
[ [Ag(NH3)2]+]
Затем отрывается вторая молекула аммиака
[Ag(NH3)]+ «Ag+ + NH3,
чему отвечает константа нестойкости по второй ступени
[Ag+] × [NH3]
Кнест II = ---------------------- =1 × 10-4.
[ [Ag(NH3)]+]
Произведение констант нестойкости по первой и второй ступеням дает общую константу нестойкости комплекса в целом:
Кнест [Ag(NH3)2]+ = Кнест I Кнест II = 6 × 10-4 ×1×10-4 = 6×10-8 .
Некоторые комплексные соединения имеют очень непрочную внутреннюю сферу и довольно большие значения констант нестойкости (>10-1). К этим соединениям, в первую очередь, относятся двойные соли, которые в твердом состоянии и в высококонцентрированных растворах имеют координационную структуру, а в разбавленных растворах распадаются на ионы, например:
K2[CuCl4] «2K+ +Cu2+ + 4Cl-.
Для комплексных соединений присуще явление изомерии, при котором вещества одного состава имеют разное молекулярное строение и разные свойства. Различают несколько видов изомерии.
1 Пространственная, или геометрическая, изомерия характерна для комплексных ионов с неоднородными лигандами, которые могут занимать разные положения вокруг комплексообразователя. В цис-изомерах одинаковые лиганды размещаются рядом, а в транс-изомерах – один против другого.
Цис-транс-изомерия проявляется в октаэдрических и квадратных комплексах и невозможна для тетраэдрических структур, а также для соединений с координационными числами 2 и 3. Количество изомеров зависит от строения комплекса и количества неодинаковых лигандов. Например, существует два пространственных изомера [PtCl2(NH3)2] с разными свойствами:
 |  |  |  |
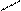
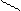
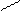
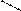 Cl NH3 NH3 Cl
Cl NH3 NH3 Cl
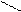
 Pt Pt
Pt Pt
Cl NH3 Cl NH3
Цис-изомер Транс-изомер
(оранжевые кристаллы) (желтые кристаллы,
менее растворимы в воде)
2 Сольватная изомерия обусловлена неодинаковым распределением молекул растворителя между внутренней и внешней сферами комплексного соединения. Если растворителем является вода, сольватную изомерию называют гидратной. Например, комплексное соединение общего состава CrCl3 × 6H2O имеет такие изомеры:
[Cr(H2O)6]Cl3, [Cr(H2O)5Cl]Cl2 × H2O,
Фиолетовый Бледно-зеленый
[Cr(H2O)4Cl2]Cl× 2H2O.
Темно-зеленый
Поскольку эти комплексы отличаются по структуре, они проявляют и разные свойства: спектры поглощения, окраска кристаллов, количество хлора, который осаждается из их растворов.
3 Ионизационная изомерия связана с разным распределением анионов между внутренней и внешней сферами. Так, комплексное соединение общего состава CoBrSO4×5NH3 имеет два ионизационных изомера: красно-фиолетовый [Co(NH3)5Br]SO4 и красный [Co(NH3)5SO4]Br. Для обоих соединений координационные емкости лигандов Br– и SO42– одинаковы и равны 1. Оба изомера различаются по своим свойствам, например:
[Co(NH3)5Br]SO4 + BaCl2 à BaSO4¯ + [Co(NH3)5Br]Cl2,
[Co(NH3)5Br]SO4 + 2AgNO3 àAg2SO4¯ +
+ [Co(NH3)5Br](NO3)2,
 [Co(NH3)5SO4]Br + BaCl2 –––>,
[Co(NH3)5SO4]Br + BaCl2 –––>,
[Co(NH3)5SO4]Br +AgNO3 à AgBr¯ + [Co(NH3)5SO4]NO3.
4 Координационная изомерия встречаетсятолько в многоядерных комплексах, когда разные комплексообразователи могут обмениваться своими лигандами без изменения общего состава:
[Cr(NH3)6][Co(CN)6] и [Co(NH3)6[Cr(CN)6],
[Pt(NH3)3Cl][Pd(NH3)Cl3] и [Pd(NH3)3Cl][Pt(NH3)Cl3],
[Co(NH3)6][Fe(CN)6] и [Fe(NH3)6][Co(NH3)6].
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 431; Нарушение авторских прав?; Мы поможем в написании вашей работы!