
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Элемент Якоби-Даниэля и сущность его работы
|
|
|
|
Условия превращения химической энергии в электрическую
Лекция 10. Гальванические элементы и электродвижущие силы
11.1 Условия превращения химической энергии в электрическую
11.2 Элемент Якоби-Даниэля и принцип его работы
11.3 Причины возникновения разности потенциалов на границах раздела фаз
11.4 Стандартный водородный электрод. стандартные электродные потенциалы, их характеристика и измерение
При протекании самопроизвольной химической реакции
Zn +CuSO4 + ΔH → ZnSO4 + Cu;
химическая энергия процесса превращается в тепловую (тепловой эффект ΔH). Для превращения химической энергии в электрическую необходимо:
а) разделить процессы окисления и восстановления химической реакции;
б) создать условия, при которых отсутствие контакта между реагирующими веществами не прекращало бы химическую реакцию (эти условия успешно реализуются вгальванических элементах (ГЭ)).
Простейший гальванический элемент состоит из двух полуэлементов, например:
Zn | ZnSO4 и Cu | CuSO4 или Zn | Zn2+ и Cu | Cu2+.
Электродные процессы как в гальванических элементах, так и при электролизе всегда связаны с изменением заряда атомов (ионов) или атомных групп, т.е. представляют собой окислительно-восстановительные реакции (ОВР). Для получения электрического тока необходимо провести ОВР в такой форме, чтобы процессы окисления и восстановления происходили бы раздельно (на разных электродах) и в результате этого электроды переводились бы в такие состояния, при которых электрические потенциалы их были различными.
Рассмотрим систему, в которой не один, а два каких-нибудь металла, например Zn и Cu, в виде пластинок опущены в растворы своих хорошо
растворимых солей, разделённые полупроницаемой перегородкой (диафрагмой).
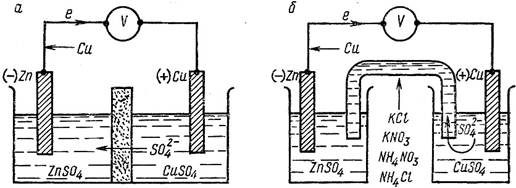
Рис. 11.1 Схема медно-цинкового гальванического элемента:
а) с пористой диафрагмой; б) с соляным мостиком.
Каждый из металлов может выделить при этом в раствор то количество ионов, которое отвечает равновесию его с раствором. Однако отвечающие такому равновесию потенциалы этих металлов неодинаковы. Цинк обладает более высокой способностью выделять ионы в раствор, чем медь, и поэтому приобретает более высокий отрицательный заряд. Если пластинки соединить проводником, то разница величины потенциалов пластинок и образование контактной разности потенциалов металлов Zn/Cu приводит к переходу соответствующего числа электронов с цинковой пластинки на медную. Это нарушает равновесие двойного электрического слоя на обеих пластинках, и с цинковой пластинки выделится вновь некоторое число ионов Zn2+ в раствор, а на медной пластинке разрядится соответствующее число ионов Cu2+. Таким образом, снова возникает разность в зарядах пластинок, вызывающая переход электронов с цинковой пластинки на медную и дальнейшее течение описанных переходов ионов. В результате возникает самопроизвольно протекающий процесс, при котором цинковая пластинка постепенно растворяется, а на медной разряжаются ионы Cu2+ и выделяется металлическая медь. Переход электронов по проволоке от цинковой пластинки к медной даёт электрический ток.
Гальваническим элементом называется любое устройство, дающее возможность получать электрический ток за счёт проведения той или иной химической реакции. Наибольшая разность потенциалов данного элемента называется его электродвижущей силой и обозначается сокращенно ЭДС.
Гальванической цепью называют последовательную совокупность всех скачков потенциала на различных поверхностях раздела, отвечающих данному гальваническому элементу.
Первые гальванические элементы были предложены ещё в середине XIX века, простейший из них элемент Якоби-Даниэля.
В основе всякой гальванической цепи лежит ОВР, проводимая так, что на одном из электродов (отрицательном) происходит окисление (в элементе Якоби-Даниэля – растворение Zn), а на другом (положительном) – восстановление (в элементе Якоби-Даниэля – выделение меди).

Электрохимические реакции вызывают направленное перемещение электронов в проводнике, т.е. в гальваническом элементе химическая энергия превращается в электрическую, которую можно использовать для полезной работы. Измеряемая при этом разность потенциалов между элементами называется ЭДС (электродвижущей силой) гальванического элемента.
Так, в основе работы элемента Якоби-Даниэля лежит химическая реакция
Zn + Cu2+ = Zn2+ + Cu или Zn + CuSO4 = ZnSO4 + Cu.
ЭДС всякого работающего элемента является величиной существенно положительной. ЭДС гальванического элемента, т.е. наибольшая разность потенциалов между электродами его равна алгебраической сумме отдельных разностей (скачков) потенциала, существующих на поверхностях раздела между различными фазами, образующими данный элемент.
Гальваническая цепь записываем следующим образом:

Обычно принято записывать цепи так, чтобы отрицательный электрод располагался слева, а положительный − справа.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 4355; Нарушение авторских прав?; Мы поможем в написании вашей работы!