
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стандартный водородный электрод. стандартные электродные потенциалы, их характеристика и измерение
|
|
|
|
Причины возникновения разности потенциалов на границах раздела фаз
Причина возникновения скачков потенциалов – переход заряженных частиц (электронов, ионов) из одной фазы в другую.
Диффузионный потенциал 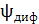 – возникает на границе раздела растворов электролитов, различающихся природой или концентрацией. В элементе Якоби-Даниэля происходит перенос ионов
– возникает на границе раздела растворов электролитов, различающихся природой или концентрацией. В элементе Якоби-Даниэля происходит перенос ионов 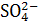 во внутренней цепи из правого полуэлемента в левый (это цепь с переносом). Контакт растворов осуществляется через пористую диафрагму или соляной мостик с использованием растворов электролитов KCI, KNO3 , NH4CI, NH4NO3, ионы которых имеют примерно одинаковую подвижность.
во внутренней цепи из правого полуэлемента в левый (это цепь с переносом). Контакт растворов осуществляется через пористую диафрагму или соляной мостик с использованием растворов электролитов KCI, KNO3 , NH4CI, NH4NO3, ионы которых имеют примерно одинаковую подвижность.
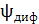 можно вычислить не всегда, поэтому часто стремятся его уменьшить (KCI
можно вычислить не всегда, поэтому часто стремятся его уменьшить (KCI 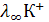 = 73,5;
= 73,5;  = 76,35 ом-1·см2·экв-1)
= 76,35 ом-1·см2·экв-1)
Для цепи
(–) Pt, CI2| HCI р-р | CI2, Pt (+)
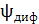 отсутствует (цепь без переноса), так как оба электрода помещают в один и тот же раствор соляной кислоты.
отсутствует (цепь без переноса), так как оба электрода помещают в один и тот же раствор соляной кислоты.
Контактный потенциал возникает при контакте между двумя металлическими электродами, если гальванический элемент имеет два одинаковых электрода в начале и в конце цепи 
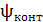 = 0 (т.к. цепь правильно разомкнута).
= 0 (т.к. цепь правильно разомкнута).
Скачок потенциала на границе электрод – раствор
При соприкосновении проводника I рода (металл) с раствором электролита (проводник II рода) на границе металл-раствор возникает двойной электрический слой (ДЭС).
Вначале представим, что цинковый электрод помещён в воду. Известно, что в кристаллической решетке металлов находятся катионы, занимающие определенные места в узлах решетки и относительно свободные электроны, движущиеся между катионами. Катионы цинка под влиянием полярных молекул воды отрываются от цинковой пластинки и переходят в слой воды, прилегающий к поверхности металла. При этом электрод заряжается отрицательно, а раствор – положительно за счёт перешедших в него катионов. Между металлом и раствором образуется двойной электрический слой и возникает скачок потенциала.
Возникновение электрического заряда на электроде препятствует дальнейшему переходу катионов в раствор. При достижении определённой концентрации ионов в растворе устанавливается динамическое равновесие, которое сопровождается непрерывным обменом катионов между металлом и раствором.
Me – ze ↔ Mez+
Zn – 2e ↔ Zn2+
Аналогичные взаимодействия происходят при погружении металла в раствор соли этого металла. Равновесие наступает, однако, при ином значении скачка потенциалов, определяемом концентрацией ионов металла в растворе. Для малоактивных металлов Cu, Ag, Au металл заряжается положительно, а прилегающий к нему раствор – отрицательно.
В результате указанных процессов раствор вблизи металла приобретает заряд, противоположный по знаку заряду металла. Образуется двойной электрический слой. Этот слой характеризуется различным распределением ионов разного знака в поверхностном слое раствора и неодинаковым распределением зарядов в поверхностном слое металла. Он связан с определённой разностью потенциалов (скачком потенциала) на поверхности раздела металл/раствор.
Толщина данного слоя в растворе зависит от концентрации раствора, от заряда металла и температуры. Слой этот в растворе обладает диффузным строением, т.е. избыточная концентрация катионов и недостаток анионов постепенно убывают по мере удаления от поверхности металла, т.к. взаимное отталкивание катионов и их тепловое движение противодействуют повышению их концентрации под действием электрического поля раствора. Этот слой в растворе часто называют диффузным слоем.
Очевидно, что если металл при погружении в раствор заряжается положительно, то в диффузном слое концентрация катионов будет понижена, а анионов – повышена по сравнению с концентрацией их в растворе.
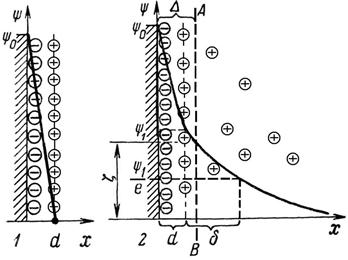
|
| Рис. 11.2 Схемы распределения ионов и падение потенциалов ДЭС: 1− по Гельмгольцу; 2− по Штерну. |
Таким образом, при погружении металла в воду или в раствор, содержащий ионы данного металла, на поверхности раздела металл/раствор образуется двойной электрический слой и возникает разность потенциалов (скачок потенциала) между металлом и раствором.
Величина этой разности потенциалов зависит от свойств металла и раствора, в особенности от концентрации ионов данного металла в растворе и от характера взаимодействия между частицами в двойном электрическом слое.
Первые представления о строении двойного электрического слоя были введены русским ученым Колли (1878), затем Гельмгольцем (1879), Гуи (1910) и Чепменом (1913).
Основы современные теории двойного электри-ческого слоя разработаны Штерном (1924), развиты академиком Фрумкиным с сотрудниками.
Установившийся равновесный потенциал 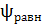 характеризуется непрерывным обменом заряженных частиц между электродом и раствором (это ток обмена, обнаружен Батлером(1936), его наличие подтверждено методом меченых частиц).
характеризуется непрерывным обменом заряженных частиц между электродом и раствором (это ток обмена, обнаружен Батлером(1936), его наличие подтверждено методом меченых частиц).
Рассмотренные металлические элементы обратимы относительно катионов – это потенциалопределяющие ионы (ПОИ), так как скачок потенциала зависит от их концентрации. В этом случае двойной электрический слой образуется в результате обмена катионами.
Существуют также электроды, обратимые относительно анионов
A + z e ↔ Az-
Для селенового электрода характерна элетрохимическая реакция
Se + 2 e ↔Se2-
В этом случае двойной электрический слой образуется в результате обмена анионами, которые являются потенциалопределяющими.
Абсолютное значение скачка потенциалов на границе электрод–раствор экспериментально измерить нельзя. Для практического определения электродного потенциала поступают следующим образом.
Опытным путём измеряют ЭДС гальванического элемента, состоящего из двух электродов, причем потенциал одного из них условно принимают за нуль.
Международным эталоном сравнения является стандартный водородный электрод Pt, H2 (p=1атм)|H2SO4 (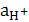 = 1моль/л). При этих условиях
= 1моль/л). При этих условиях  =0 (при всех Т).
=0 (при всех Т).
Электродный процесс 2H+ +2e ↔ H2

Рис. 11.3 Водородный электрод
На основе решений Международной конвенции (Стокгольм, 1953) для определения электродного потенциала составляют цепь:

Этот процесс протекает и в гальваническом элементе, поток электронов направляется от Zn (эл.) → H2 (эл.)

В первом случае значение ЭДС отрицательное (–) – поток электронов справа → налево.
Во втором случае значение ЭДС положительное (+) – поток электронов слева → направо.
Так как 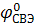 = 0, то ЭДС цепи равна электродному потенциалу измеряемого электрода.
= 0, то ЭДС цепи равна электродному потенциалу измеряемого электрода.
При условии, что aПОИ=1моль/л, электродные потенциалы называют стандартными, значения 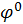 табулированы при 25ºС, они зависят от химической природы электрода, от заряда его ионов в растворе и выражаются в вольтах (В).
табулированы при 25ºС, они зависят от химической природы электрода, от заряда его ионов в растворе и выражаются в вольтах (В).
Стандартные электродные потенциалы некоторых электродов
в водных растворах при 25ºС
Таблица 11.1
| электрод | электродный процесс | φº, В | электрод | электродный процесс | φº, В |
| Li/Li+ | Li+ + е ↔ Li | −3,05 | Cd/Cd2+ | Cd2+ + 2 е ↔ Cd | –0,40 |
| К/К+ | К+ + е ↔ К | −2,92 | Ni/Ni2+ | Ni2+ + 2 е ↔ Ni | −0,25 |
| Ca/Ca2+ | Ca2+ + 2 е ↔ Ca | −2,87 | Pb/Pb2+ | Pb2+ + 2 е ↔ Pb | −0,13 |
| Na/Na+ | Na+ + е ↔ Na | –2,71 | Fe/Fe3+ | Fe3+ + 3 е ↔ Fe | −0,04 |
| Mg/Mg2+ | Mg2+ + 2 е ↔ Mg | −2,36 | H2/H+ | H+ + е ↔ ½ H2 | 0,0 |
| AI/AI3+ | AI3+ + 3 е ↔ AI | −1,67 | Cu/Cu2+ | Cu2+ + 2 е ↔ Cu | +0,34 |
| Zn/Zn2+ | Zn2+ + 2 е ↔ Zn | −0,76 | Cu/Cu+ | Cu+ + е ↔ Cu | +0,52 |
| Fe/Fe2+ | Fe2+ + 2 е ↔ Fe | –0,44 | Hg/Hg2+ | Hg2+ + 2 е ↔ Hg | +0,79 |
Расположенные в порядке возрастания стандартных электродных потенциалов металлы представляют собой известный ряд напряжения металлов.
| −3,05 | −2,92 | −2,87 | −2,36 | −1,67 | −0,76 | −0,25 | −0,13 | −0,04 | 0,0 | +0,34 | +0,52 | +0,80 | +1,50 |
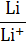
| 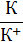
| 
| 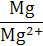
| 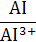
| 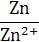
| 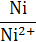
| 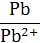
| 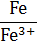
| 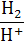
| 
| 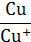
| 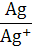
| 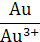
|
Если aПОИ ≠1, то φ не является стандартным и его зависимость.
 дается уравнением Нернста.
дается уравнением Нернста.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1068; Нарушение авторских прав?; Мы поможем в написании вашей работы!