
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ферментов
|
|
|
|
Влияние различных факторов на функционирование
Факторы, определяющие характер течения ферментативных реакций: концентрации фермента и субстрата, рН, температура, наличие активаторов или ингибиторов.
1. Влияние концентрации фермента. При данных условиях две молекулы фермента, действующие в растворе независимо друг от друга, за определенный промежуток времени вызовут превращение в два раза большего количества субстрата, чем одна молекула. Поэтому скорость (v) реакции прямо пропорциональна концентрации фермента Е:'
v = kE

В большинстве случаев графически это можно представить в виде линейных зависимостей, широко используемых в методах определения концентрации ферментов (рис.).
2. Влияниеконцентрации субстрата на скорость ферментативной реакции базируется на теории Михаэлиса.
Фермент Е вначале образует со своим субстратом комплекс ЕS, который затем распадается с освобождением фермента и продуктов реакции:
k+1 k+2
E + S ↔ ES ® Е + Р
k-1
Р – продукты реакции.
Представление об образовании фермент-субстратного комплекса является главным для всех современных концепций о механизме действия ферментов, которые объясняют закономерности изменения скорости ферментативной реакции.
При очень низких концентрациях субстрата скорость реакции очень мала, но постепенно возрастает по мере повышения концентрации субстрата.
Скорость, когда фермент «насыщен» субстратом, принимают за максимальную (vmaх). Однако сколько бы ни увеличивалась концентрация субстрата, скорость ферментативной реакции приближается к максимальной, но никогда не достигает ее. График зависимости между начальной скоростью реакции и концентрацией субстрата представляет собой часть равнобочной гиперболы (рис.).
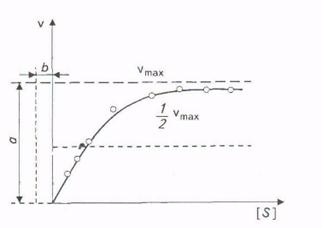 Рис. Зависимость скорости реакции от концентрации субстрата
Рис. Зависимость скорости реакции от концентрации субстрата
|

|

 Эти исследования имеют и большое практическое значение, так как позволяют подобрать наилучшие условия для эффективного действия ферментов.
Гис. 3.3. Влияние концентрации
фермента на скорость реакции при
гидролизе коллагена:
' 1 — коллагеназой тканей; 2 — протосубтили-ном; 3— пепсином
Факторы, определяющие характер течения ферментативных реакций, многочисленны и разнообразны. К главным из них относятся: концентрации фермента и субстрата, рН, температура, наличие активаторов или ингибиторов.
При данных условиях две молекулы фермента, действующие в растворе независимо друг от друга, за определенный промежуток времени вызовут превра-
_ ————— ___.,. -.^~^^1»
центрации фермента ([Е\)'.
щение в два раза большего количества субстрата, чем одна молеку ла. Поэтому скорость (v) реакции прямо пропорциональна кон ет '
у = ад (3.1)
В подавляющем большинстве случаев графически это можно представить в виде линейных зависимостей, широко используемых в методах определения концентрации ферментов (рис. 3.3).
Иногда линейность графика нарушается, что обусловлено свойствами самого фермента или несовершенством методов опрееле
деления активности.
.
Влияние концентрации субстрата на скорость ферментативной реакции базируется на теории Михаэлиса.
Как правило, в ферментативных реакциях участвует не один, а большее число субстратов. Гидролазные реакции часто рассматривают как односубстратные, так как второй субстрат присутствует в очень высоких концентрациях и можно считать, что фермент постоянно насыщен водой.
сывается уравнением вида:
Рассматривая кинетику односубстратных реакций, следует подчеркнуть, что концентрация субстрата — один из наиболее важных факторов, определяющих скорость. Практически во всех случаях график зависимости между начальной скоростью и концентрацией субстрата представляет собой часть гиперболы и опи-
Эти исследования имеют и большое практическое значение, так как позволяют подобрать наилучшие условия для эффективного действия ферментов.
Гис. 3.3. Влияние концентрации
фермента на скорость реакции при
гидролизе коллагена:
' 1 — коллагеназой тканей; 2 — протосубтили-ном; 3— пепсином
Факторы, определяющие характер течения ферментативных реакций, многочисленны и разнообразны. К главным из них относятся: концентрации фермента и субстрата, рН, температура, наличие активаторов или ингибиторов.
При данных условиях две молекулы фермента, действующие в растворе независимо друг от друга, за определенный промежуток времени вызовут превра-
_ ————— ___.,. -.^~^^1»
центрации фермента ([Е\)'.
щение в два раза большего количества субстрата, чем одна молеку ла. Поэтому скорость (v) реакции прямо пропорциональна кон ет '
у = ад (3.1)
В подавляющем большинстве случаев графически это можно представить в виде линейных зависимостей, широко используемых в методах определения концентрации ферментов (рис. 3.3).
Иногда линейность графика нарушается, что обусловлено свойствами самого фермента или несовершенством методов опрееле
деления активности.
.
Влияние концентрации субстрата на скорость ферментативной реакции базируется на теории Михаэлиса.
Как правило, в ферментативных реакциях участвует не один, а большее число субстратов. Гидролазные реакции часто рассматривают как односубстратные, так как второй субстрат присутствует в очень высоких концентрациях и можно считать, что фермент постоянно насыщен водой.
сывается уравнением вида:
Рассматривая кинетику односубстратных реакций, следует подчеркнуть, что концентрация субстрата — один из наиболее важных факторов, определяющих скорость. Практически во всех случаях график зависимости между начальной скоростью и концентрацией субстрата представляет собой часть гиперболы и опи-
 сывается УПЯКНРНИРМ ПМПЯ-
Фермент Е вначале образует со своим субстратом ^ комплекс Е5, который затем распадается с освобождением свободного фермента и продуктов реакции:
сывается УПЯКНРНИРМ ПМПЯ-
Фермент Е вначале образует со своим субстратом ^ комплекс Е5, который затем распадается с освобождением свободного фермента и продуктов реакции:
 Представление об образовании фермент-субстратного комплекса является главным для всех современных концепций о механизме действия ферментов, которые объясняют закономерности изменения скорости ферментативной реакции.
При очень низких концентрациях субстрата скорость реакции весьма мала, но постепенно возрастает по мере повышения концентрации субстрата. В условиях возрастающих концентраций субстрата каждый раз приращение скорости становится все мень-16 и меньше до бесконечно малого ускорения.
Скорость, когда фермент «насыщен» субстратом, принято при-|нимать за максимальную (утах). В таком состоянии он не может функционировать быстрее.
Эффект насыщения свойствен почти всем ферментам. Однако, сколько бы ни увеличивалась концентрация субстрата, фактически скорость ферментативной реакции приближается к максимальной, но никогда не достигает ее. Практически во всех случаях график зависимости между начальной скоростью реакции и концентрацией субстрата представляет собой часть равнобочной гиперболы (рис. 3.4).
Благодаря тому что гипербола, изображенная на рис. 3.4, имеет •одинаковую форму для большинства ферментов, Михаэлис и Шентен в 1913г. определили константу, обозначаемую в настоя-
Рис. 3.4. Зависимость скорости реакции от концентрации субстрата
Представление об образовании фермент-субстратного комплекса является главным для всех современных концепций о механизме действия ферментов, которые объясняют закономерности изменения скорости ферментативной реакции.
При очень низких концентрациях субстрата скорость реакции весьма мала, но постепенно возрастает по мере повышения концентрации субстрата. В условиях возрастающих концентраций субстрата каждый раз приращение скорости становится все мень-16 и меньше до бесконечно малого ускорения.
Скорость, когда фермент «насыщен» субстратом, принято при-|нимать за максимальную (утах). В таком состоянии он не может функционировать быстрее.
Эффект насыщения свойствен почти всем ферментам. Однако, сколько бы ни увеличивалась концентрация субстрата, фактически скорость ферментативной реакции приближается к максимальной, но никогда не достигает ее. Практически во всех случаях график зависимости между начальной скоростью реакции и концентрацией субстрата представляет собой часть равнобочной гиперболы (рис. 3.4).
Благодаря тому что гипербола, изображенная на рис. 3.4, имеет •одинаковую форму для большинства ферментов, Михаэлис и Шентен в 1913г. определили константу, обозначаемую в настоя-
Рис. 3.4. Зависимость скорости реакции от концентрации субстрата
|
Благодаря тому, что гипербола имеет одинаковую форму для большинства ферментов, Михаэлис и Mентен в 1913г. определили константу, Кт, для обозначения соотношения между концентрацией субстрата и скоростью катализируемой ферментом реакции. Величина Кт означает концентрацию субстрата, при которой данный фермент обеспечивает скорость реакции, равную половине ее максимальной скорости. Физический смысл Кт фактически показывает степень сродства фермента и субстрата. Характерная форма кривой насыщения фермента субстратом может быть выражена математически уравнением Михаэлиса-Ментен:
v0 = vmax [S] / (Km + [S]),
где v0 - начальная скорость реакции при концентрации субстрата [S]; vmax - максимальная скорость реакции; Кт - константа Михаэлиса - Ментен для данного фермента, соответствующая определенному субстрату.
|
|
Это уравнение было выведено исходя из предположения о том, что стадией, лимитирующей скорость ферментативных реакций, является распад комплекса ЕS на продукты распада и свободный фермент. Уравнение Михаэлиса - Ментен составляет основу для анализа кинетики всех ферментативных реакций. Если известны величины Кт и vmax, то можно рассчитать скорость ферментативной реакции при любой заданной концентрации субстрата. Уравнение позволит определить количественные характеристики ферментов и провести анализ их ингибирования.
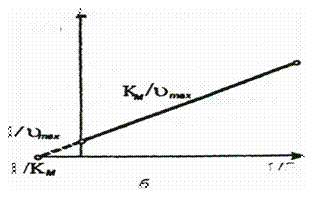
Для определения vmax и Кт по данным измерений скорости при различных концентрациях субстрата график уравнения Михаэлиса - Ментен может быть построен несколькими способами. Чаще всего используют метод графического изображения по Лайнуиверу - Бэрку. Если построить график зависимости 1/v от 1/[S] и воспользоваться методом двойных обратных величин, то получится уравнение прямой линии вида:
1 = Km 1 + 1
v0 vmax [S] vmax
|
1/v
1/S
Прямая пересекает ось ординат в точке 1/ vmax под углом, равным Km/ vmax.
Величина Кт - ключевое звено в уравнении Михаэлиса - Ментен. Она характеризует действие данного фермента по отношению к тому или иному субстрату при определенных значениях рН и температуры.
Следует отметить, что одни ферменты требуют довольно высоких концентраций субстрата для достижения скорости, равной половине максимальной, другим достаточно очень низких концентраций субстрата.
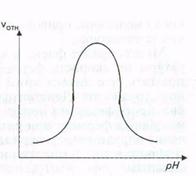
Ферменты активны только в определенном интервале рН; в большинстве случаев для каждого фермента имеется свой определенный оптимум рН.
Это объясняется несколькими причинами:
1) истинное обратимое влияние рН на скорость реакции v (когда фермент насыщен субстратом);
2) влияние рН на сродство фермента к субстрату (в этом случае падение активности по обе стороны от оптимума рН будет следствием понижения насыщения фермента субстратом в силу понижения сродства):
3) влияние рН на стабильность фермента, который может необратимо инактивироваться при рН пo одну или обе стороны от оптимума Перечисленные факторы могут действовать и в комбинации друг с другом. Например, падение активности по одну сторону от оптимума рН может быть результатом уменьшения сродства фермента к субстрату, а по другую - результатом инактивации фермента.
Для всех известных ферментов зависимость относительной скорости реакции от рН графически выражается в виде «колоколообразной» функции (рис.).
ионизации.
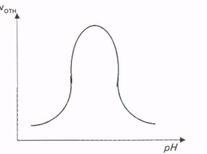 Рис. Зависимость скорости ферментативной реакции от рН
Рис. Зависимость скорости ферментативной реакции от рН
|
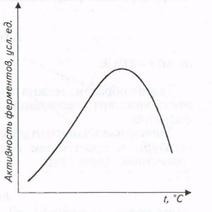
Зависимость скорости ферментативных реакций от температуры также имеет колоколообразную форму в достаточно широком температурном интервале (рис.).
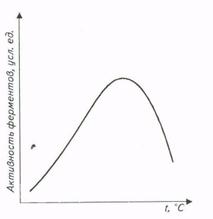 Рис. Влияние температуры на активность ферментов
Рис. Влияние температуры на активность ферментов
|
Наличие температурного оптимума реакции объясняется наложением двух эффектов - возрастанием скорости реакции при увеличении температуры и ускорением тепловой денатурации белковой молекулы, приводящей к инактивации фермента при высоких температурах.
Действие большинства ферментов можно также подавить или полностью ингибировать определенными химическими реагентами. Очевидно, химические вещества, в широком ассортименте присутствующие в биологических объектах (пищевом сырье), во многом предопределяют направленность и эффективность суммарных ферментативных превращений.
Известно много ферментов, для которых естественные условия их действия не совпадают с оптимальными параметрами рН и температуры. Изучение влияния ингибиторов ферментов позволяет получить ценные сведения о субстратной специфичности энзимов, природе функциональных групп активного центра и механизмах их каталитической активности. Ингибиторы ферментов служат очень полезными инструментами при исследовании метаболических путей в клетках.
Ферменты повышают скорости катализируемых ими реакций в 108 - 1020 раз.
Механизм действия ферментов тесно связан со структурой и строением фермента и субстрата. Важную роль играет структура и строение белка, а именно: молекулярная масса, число пептидных цепей и последовательность аминокислот, упаковка и расположение пептидных цепей в молекуле фермента, число активных центров в молекуле белка, природа активного центра: химическая природа субстратсвязывающих и активизирующих групп, присутствующих в активном центре, а также небелковая часть, если она имеется.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 484; Нарушение авторских прав?; Мы поможем в написании вашей работы!