
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Р-элементы VI группы
|
|
|
|
К р-элементам VI группы относятся кислород, сера, селен, теллур, полоний. На рисунке 6.1. приведены энергетические диаграммы валентных зон данных элементов из которых видно, что данные элементы могут проявлять валентности 2, 4, 6.
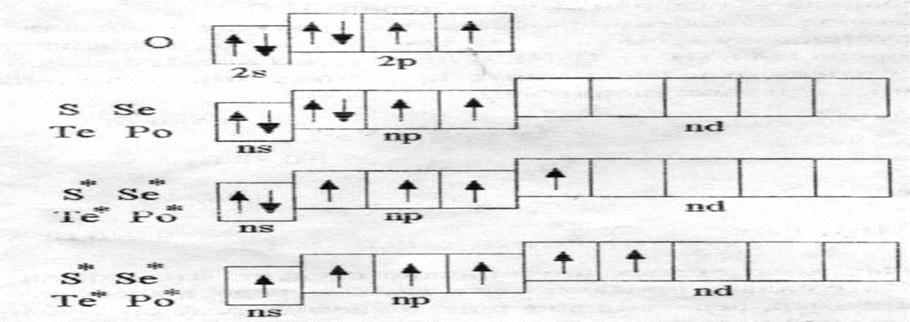
Рисунок 6.1. Энергетические диаграммы валентных зон
Кислород является самым распространённым элементом земной коры. Молекула кислорода двухатомна (О2). Простое вещество - молекулярный кислород - представляет собой газ без цвета и запаха, плохо растворимый в воде.
В атмосфере Земли содержится 21 % (по объёму) кислорода.
Аллотропной модификацией кислорода является озон (O3). Озон - один из сильнейших окислителей; по окислительной активности он уступает только фтору. Он окисляет все металлы, кроме золота и платиновых металлов, а также большинство неметаллов. В стратосфере земли образует озоновый слой, поглощающий основную часть ультрафиолетового излучения.
Важным соединением кислорода является Н2О2 – пероксид водорода (Н–О–О–Н).
Сера. Сероводородная кислота является слабой двухосновной кислотой
Н2S ↔ H+ + НS-, К1 = 6∙10-8,
НS- ↔ H+ + S-2, К2 = 1∙10-14.
Оксид серы (IV) образуется при горении серы на воздухе. Он хорошо растворяется в воде с образованием сернистой кислоты
SO2 + Н2O ↔ H2SO3.
Сернистая кислота – слабая двухосновная кислота (К1=1,6∙10-2, К2=6∙10-8).
Н2SО4 - сильная двухосновная кислота.
Н2SO4 → 2 Н+ + SO42-.
Концентрированная серная кислота, особенно горячая, - энергичный окислитель. Она восстанавливается до SO2, S или Н2S. Чем более активен металл, тем более глубоко восстанавливается кислота.
Сu + 2 Н2SO4 (конц.) → СиSO4 + SO2↑ + 2 Н2O;
3 Zn + 4 Н2SO4(конц.) → 3 ZnSО4 + S↓ + 4 Н2O.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 400; Нарушение авторских прав?; Мы поможем в написании вашей работы!