КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изотермы реальных газов. Фазовая диаграмма
|
|
|
|
Таким образом, энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано макросостояние. Следовательно, энтропия может рассматриваться как мера вероятности состояния термодинамической системы.
Все самопроизвольно протекающие процессы в замкнутой системе, приближающие систему к состоянию равновесия и сопровождающиеся ростом энтропии, направлены в сторону увеличения вероятности состояния.
 (15)
(15)
т.е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
Так как энтропия возрастает только в неравновесном процессе, то ее увеличение происходит до тех пор, пока система не достигнет равновесного состояния. Следовательно, равновесное состояние соответствует максимуму энтропии. С этой точки зрения энтропия является мерой близости системы к состоянию равновесия, т.е. к состоянию с минимальной потенциальной энергией.
 3. Реальные газы. Уравнение Ван-дер-Ваальса.
3. Реальные газы. Уравнение Ван-дер-Ваальса.
|
Поведение реального газа отличается от поведения идеального газа. Так, радиус молекул большинства газов порядка 10-10 м (1Ǻ), следовательно, объем молекул порядка 4×10-30 м3. В 1 м3 газа при нормальных условиях содержится 2,7×1025 молекул. Таким образом, собственный объем молекул в 1 м3 при нормальных условиях будет порядка 1,2 ×10-4 м3, т.е. около 0,0001 от объема, занятого газом.
Любое вещество в зависимости от параметров состояния может находиться в различных агрегатных состояниях: твердом, жидком, газообразном, плазменном.
Нидерландский физик Ван-дер-Ваальс ввел две поправки в уравнение Менделеева-Клапейрона:

|
1. Учет собственного объема молекулы 
Объем одной молекулы:  ;
;
Недоступный объем пары молекул (в расчете на одну молекулу):
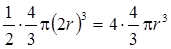 - учетверенный объем молекулы.
- учетверенный объем молекулы.
Недоступный объем на все NA молекул одного киломоля:

2. Учет силы межмолекулярного взаимодействия 
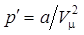 - внутреннее давление; а – постоянная Ван-дер-Ваальса, характеризую-щая силы межмолекулярного притяжения.
- внутреннее давление; а – постоянная Ван-дер-Ваальса, характеризую-щая силы межмолекулярного притяжения.
Уравнение Ван-дер-Ваальса для одного моля газа (уравнение состояния реальных газов):
 . (16)
. (16)
Уравнение Ван-дер-Ваальса для произвольной массы газа
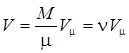

 . (17)
. (17)
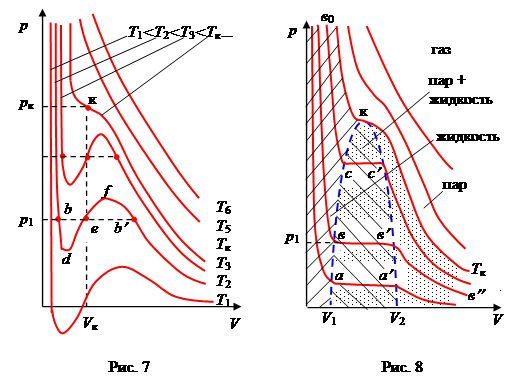
При фиксированных значениях давления и температуры уравнение (16) имеет три корня относительно V (V 1, V 2, V 3)
(V m - V 1 )×(V m - V 2 )×(V m - V 3 ) = 0.
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 490; Нарушение авторских прав?; Мы поможем в написании вашей работы!