
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
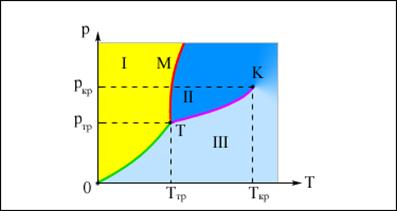
Изотермы Ван-дер-Ваальса
|
|
|
|
Критической называется такая наименьшая температура, выше которой вещество может находиться только в парообразном состоянии (сжижение невозможно). Для гелия t кр= -268 оС, для водорода t кр= -240 оС.
OT -кривая сублимации.
TK -кривая испарения,
|
TM -кривая плавления.
Для многих веществ давле-ние pтр в тройной точке меньше 1 атм ≈ 105 Па. Такие вещества при нагревании при атмос-ферном давлении плавятся.
Например, для воды Tтр = 273,16 К, pтр = 6,02·102 Па.
Существуют и такие веще-ства, у которых pтр превышает 1 атм.
Так для углекислоты (CO2) pтр = 5,11 атм, Tтр = 216,5 К. Поэтому при атмосферном давлении твердая углекислота может существовать только при низкой температуре, а в жидком состоянии при p = 1 атм она вообще не существует. В равновесии со своим паром при атмосферном давлении углекислота находится при температуре 173 К или –80 °С в твердом состоянии. Это широко применяемый «сухой лед», который никогда не плавится, а только испаряется (сублимирует).
4. Внутренняя энергия реального газа. Эффект Джоуля – Томсона
Внутренняя энергия реального газа:
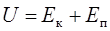 , (18)
, (18)
 .
.
Потенциальная энергии взаимодействия молекул при расширении газа от объема V 1 до V 2 равна работе силы молекулярного давления р¢



 .
.
Потенциальная энергия отрицательна, так как молекулярные силы, создающие внутреннее давление р¢, являются силами притяжения и при увеличении объема они уменьшаются.
 . (19)
. (19)
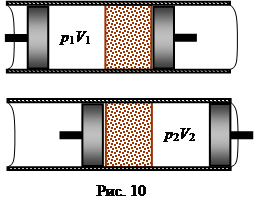
|
Опыт Джоуля и Томсона по адиабатному перетеканию газа через пористую перегородку.
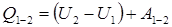

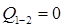


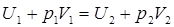



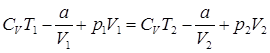

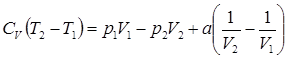

 (20)
(20)
Процесс изменения температуры реального газа при адиабатическом продавливании его через пористую перегородку называется дросселированием.
При дросселировании возможно несколько случаев изменения температуры газа (эффект Джоуля – Томсона):
1) газы, расширяясь, охлаждаются (положительный эффект Джоуля – Томсона);
2) газы, расширяясь, нагреваются (отрицательный эффект Джоуля – Томсона);
3) температура газа при его расширении не изменяется (инверсия).
Эффект Джоуля – Томсона используется в машинах Линде (немецкий физик, 1842-1934) для получения сжиженных газов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 403; Нарушение авторских прав?; Мы поможем в написании вашей работы!