
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Будова колоїдної частинки. Взаємодія між колоїдними частинками
|
|
|
|
Тема 11. Седиментаційна та кінетична стійкість колоїдних систем.
Види колоїдів
За розміром часток золі займають проміжне положення між щирими розчинами і грубодисперсними системами - порошками, суспензіями, емульсіями.
Тому, всі методи одержання колоїдних систем можна розбити на 2 основні групи:
1. диспергування - дроблення великих часток грубодисперсних систем до колоїдної дисперсності;
2. конденсація - сполука атомів, іонів або молекул у більші частки (агрегати) колоїдних розмірів.
Істинний
 розчин
(10-8 см) розчин
(10-8 см)
| Колоїдний
 розчин
(10-6-10-5 см) розчин
(10-6-10-5 см)
| Грубодисперсні системи (> 10-5см) | |
| Методи конденсації | Методи диспергування | ||
По відношенню коллоїдів до дисперсного середовища (води) колоїдні частинки поділяють на
1 – ліофільні – це такі, які утворюють з молекулами води комплекси (ліо – рідина; філіо – люблю);
2 – ліофобні (гідрофобні) – які не утворюють з водою комплексів; (фобос – боязнь)
По відношенню до води такі колоїди називаються гідрофільними і гідрофобними. Між цим колоїдами існує така різниця:
1. Гідрофільні коллоїди після злипання частинок - (коагуляції) вміщують велику кількість розчинника (води). (Це крохмаль, клей, желатин). Гідрофобні мають вигляд окремих пластівців (порошків) - це гідроксиди, оксиди металів.
2. Гідрофільні мають в‘язкість чи густину значно більшу ніж чистий розчинник. Гідрофобні мають такуж саму вязкізть як і розчинник.
3. Гідрофільні коагулюють з утворенням такого осаду, який може переходити у первинний стан, тобто коагуляція процес зворотній. Такі колоїди переходячи у первинний стан наприклад при перемішуванні. Осад гідрофобних колоїдів не можна перевести у зворотній стан, без дії деяких хімікатів.
4. Гідрофільні колоїди з часом утворюють з розчинником (водою) суцільну масу - наприклад желе, студень. Гідрофобні колоїди єдину масу з розчинником не утворюють.
Оскільки колоїдні частки мають дуже малі розміри, то вони повільно осідають у нерухомій воді. Згідно закону Стокса – чим більше діаметр такої частинки тим швидше вона сідає у такій воді. Але на відміну від крупних частинок, колоїдні осідають доволі повільно. Так частинка d=0,1 мм осідає на глибину 1 за 1 годину, а колоїдна частника d=10-5 за сто років.
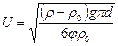
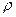 - густина частинки;
- густина частинки; 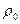 - густина води; g – 9,8 м/с2; d – діаметр частинки,
- густина води; g – 9,8 м/с2; d – діаметр частинки,  - коефіцієнта гідравлічного опору.
- коефіцієнта гідравлічного опору.
ця залежність називається формулою Стокса. Вона показує, що при однаковій густині завислих частинок швидкість осадження їх у нерухомій воді збільшується із збільшенням діаметру, тому завислу частинку можна характеризувати швидкістю їх осадження, яка називається гідравлічна крупніють частинки і записується мм/с.
Стійкість і коагуляція дисперсних систем
Дисперсні системи поділяють на ліофільні та ліофобні. Відмінність у характері прояву сил міжмолекулярної взаємодії на межі поділу фаз дисперсної системи зумовлює різний механізм стабілізації і коагуляції ліофобних та ліофільних колоїдів. Ліофільні системи характеризуються сильною міжмолекулярною взаємодією часточок дисперсної фази з дисперсійним середовищем (водою), довільним диспергуванням і термодинамічною стійкістю системи. До ліофільних належать мила, агрегати високомолекулярних сполук тощо, які утворюють у водному середовищі необмежено стійкі дисперсні системи. Ліофобні системи характеризуються значною енергією зв'язку всередині дисперсної фази, яка значно перевищує енергію взаємодії її з середовищем. У цьому разі диспергування відбувається під дією зовнішніх сил — механічних та хімічних. Для ліофобних колоїдів розрізняють седиментаційну і агрегативну стійкість.
Седиментаційною називають стійкість дисперсії відносно сили гравітації. Розділення фаз у цьому випадку відбувається як осадженням часточок під дією сил гравітації, так і втратою агрегативної стійкості в результаті об'єднання часточок при добавлянні електролітів і флокулянтів, а також під дією інших чинників, наприклад нагрівання.
Отже, під агрегативною стійкістю розуміють здатність протистояти злипанню часточок. Тонкодисперсні колоїдні розчини (золі, мікроемульсії) відрізняються від грубодисперсних суспензій (зависей) високою агрегативною стійкістю. Між колоїдними часточками діють сили притягання і відштовхування. Стійкість дисперсної системи залежить від хімічної природи поверхні часточок і визначається балансом сил притягання і відштовхування. Переважно між часточками діють молекулярні сили притягання — сили Ван-дер- Ваальса, електростатичні сили відштовхування (в деяких випадках вони можуть викликати притягання), структурні сили відштовхування, спричинені взаємодією адсорбованих макромолекул. Молекулярні та електростатичні сили є універсальними, дія яких спостерігається завжди, навіть у разі переважання інших сил. Сили відштовхування адсорбованих молекул і структурні більш специфічні. Останні діють лише поблизу ліофільних або ліофілізованих (наприклад, за рахунок адсорбції поверхнево-активних речовин) поверхонь, перші — за наявності достатньо довгих адсорбційних шарів високомолекулярних сполук.
(Встановлено, що в колоїдних системах коагулюючими є йони електролітів, які несуть протилежний часточці заряд (протиіони), і концентрація цих протиіонів зменшується в міру збільшення їхнього заряду. Це відбито в правилі Шульце-Гарді, коагулюючу дію чинить протиіон і коагулююча здатність зростає пропорційно деякому високому степеню його заряду. Мінімальна концентрація електроліту або іншого реагенту, що викликає перехід системи із стійкого в нестійкий стан, називається порогом коагуляції, або коагулюючою (критичною) концентрацією. Протиіони з однаковою величиною заряду, маючи близькі, пороги коагуляції, все-таки дещо різняться за своєю дією і розміщуються в такий ліотропний ряд: Li+ < Na+ < К+ < NH4+ < Rb+ < Cs+. Звідси випливає, що чим сильніший гідратований йон, тим нижча його коагулююча здатність. Зазначені факти свідчать про йонно-електростатичний механізм стабілізації колоїдів).
За сучасними уявленнями, стійкість ліофобних колоїдів визначається балансом сил електростатичного відштовхування і молекулярного притягання між часточками. Кількісна теорія стійкості була розроблена в колишньому СРСР Дерягіним і Ландау і пізніше незалежно від них у Голландії Фервеєм і Овербеком (теорія ДЛФО). Вона визнана науковцями і застосовується для пояснення різних явищ, які спостерігаються під час коагуляції ліофобних колоїдів електролітами та їхніми сумішами.
Електростатичні сили відштовхування. У дисперсній системі на межі поділу фаз виникає подвійний електричний шар (ПЕШ). У разі зближення колоїдних часточок внаслідок взаємодії у ПЕШ виникають електростатичні сили відштовхування. Величина цих сил залежить від параметрів шару: розподілу зарядів і потенціалів та їх змін у разі добавляння електролітів, поверхнево-активних речовин і полімерів. Утворення поверхневого заряду часточок може відбуватися внаслідок:
дисоціації поверхневих груп (наприклад, поверхневих ОН-груп важкорозчинних гідроксидів);
адсорбції потенціалвизначальних йонів (йонів, що входять до кристалічних граток, наприклад, утворення заряду йонних кристалів йодиду аргентуму за рахунок адсорбції йонів Аg+ або I+;
адсорбції йоногенних поверхнево-активних речовин;
ізоморфного заміщення (наприклад, за рахунок заміщення йонів Sі4+ на йони АІ3+ або Са2+ з виникненням дефіциту позитивного заряду на часточці).
Густину поверхневого заряду, що дорівнює числу елементарних зарядів на одиниці поверхні, можна визначити за формулою

де F — число Фарадея; Iп+, Iон - — кількість йонів, адсорбованих на 1 см2 поверхні.
Різницю (IH+ - IOH-) можна визначити за даними потенціометричного титрування.
Шари локалізованих на поверхні йонів, що створюють заряд, формують внутрішню обкладку ПЕШ. Ці йони компенсуються такою самою кількістю протилежно заряджених йонів, які становлять зовнішню обкладку цього шару. Відповідно до загальноприйнятої моделі Гуї—Штерна, зовнішню обкладку ПЕШ умовно поділяють на дві зони: щільна частина з моношару протиіонів, що прилягають безпосередньо до поверхні, і дифузна частина, в якій розподіл йонів визначається конкуренцією між Шари локалізованих на поверхні йонів, що створюють заряд, формують внутрішню обкладку ПЕШ. Ці йони компенсуються такою самою кількістю протилежно заряджених йонів, які становлять зовнішню обкладку цього шару. Відповідно до загальноприйнятої моделі Гуї—Штерна, зовнішню обкладку ПЕШ умовно поділяють на дві зони: щільна частина з моношару протиіонів, що прилягають безпосередньо до поверхні, і дифузна частина, в якій розподіл йонів визначається конкуренцією між електричним полем сусідньої фази, яке притягує протилежно заряджені і відштовхує однойменно заряджені йони, і тепловим рухом, який прагне рівномірно розподілити йони в просторі. У дифузній частині протиіони утримуються біля поверхні електростатичними силами, а в повній (штернівській) — до них долучаються специфічні адсорбційні сили. Отже, заряд поверхні компенсується сумою зарядів, локалізованих у щільній (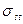 ) і дифузній (
) і дифузній ( ) частинах ПЕШ:
) частинах ПЕШ:
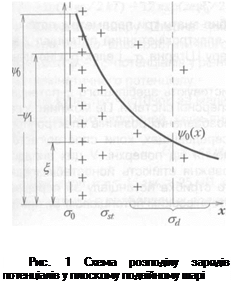 Розрізняють поверхневий
Розрізняють поверхневий  , штернівський (
, штернівський ( ) електрокінетичний (
) електрокінетичний (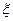 ) потенціали ПЕШ. Схематична будова плоского ПЕШ, за Гуї-Штерном, зображена на рис. 1. Величина визначається стрибками потенціалу між поверхнею і точкою далеко від неї (в глибині розчину). Електрокінетичний потенціал відповідає потенціалу площини ковзання фаз у разі їх відносного переміщення в результаті дії зовнішніх сил. Для багатьох дисперсних систем величина
) потенціали ПЕШ. Схематична будова плоского ПЕШ, за Гуї-Штерном, зображена на рис. 1. Величина визначається стрибками потенціалу між поверхнею і точкою далеко від неї (в глибині розчину). Електрокінетичний потенціал відповідає потенціалу площини ковзання фаз у разі їх відносного переміщення в результаті дії зовнішніх сил. Для багатьох дисперсних систем величина 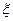 -потенціалу менша від значень
-потенціалу менша від значень  або
або  -потенціалів, що пояснюють наявністю на поверхні полімолекулярного шару рідини із зниженою гідродинамічною рухливістю або шорсткістю поверхні реальних тіл.
-потенціалів, що пояснюють наявністю на поверхні полімолекулярного шару рідини із зниженою гідродинамічною рухливістю або шорсткістю поверхні реальних тіл.
Розподіл йонів у дифузній частині ПЕШ описується теорією Гуї—Чепмена, яка розглядає тільки електростатичну взаємодію і моделює йони зарядженими точками. Розподіл йонів визначається їх зарядом, а не об'ємом, формою та поляризованістю. Прийнявши, що концентрація йонів по перерізу ПЕШ описується законом Больцмана, а розподіл потенціалу — рівнянням Пуассона, теорія Гуї-Чепмена.
Незалежно від застосовуваних методів одержання колоїдних систем, до загальних умов їхнього одержання відносяться наступні:
1. Нерозчинність речовини дисперсної фази в дисперсійному середовищі.
2. Досягнення колоїдної дисперсності частинками дисперсної фази.
3. Наявність у системі, у якій утворяться частинки дисперсної фази, третього компонента - стабілізатора, що повідомляє системі агрегативну стійкість (найчастіше ПАР (поверхнево-активні речовини), у тому числі високомолекулярні сполуки).
Молекули стабілізатора створюють навколо частинок дисперсної фази захисний шар, що охороняє частинки від агрегування. (Так одержують дисперсії полімерів у воді, емульсії, піни, суспензії)
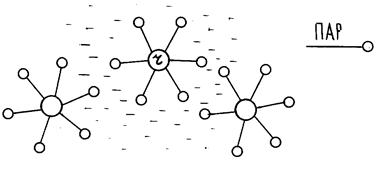
Рис. 2. Стабілізація колоїдної системи за допомогою ПАР
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1888; Нарушение авторских прав?; Мы поможем в написании вашей работы!