
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальна характеристика сірковмісних органічних сполук
|
|
|
|
Сірка – елемент VІ групи періодичної системи Д.І. Менделєєва. За електронною будовою подібний кисню. Валентні електрони в атомі сірки знаходяться на третьому енергетичному рівні. В атомі сірки легко здійснюється перехід електронів на вакантні 3d-орбіталі, так як ВЗО (3р-) і НВО (3d-) близькі за енергією. Тому поряд з дво- та чотирьохвалентною сіркою відомі сполуки шестивалентної сірки. Наприклад, в утворенні SF6 приймають участь шість орбіталей атома сірки, в тому числі дві 3d-орбіталі. Так як в атомі сірки валентні електрони далеко віддалені від ядра, легко поляризуються, ніж в атомі кисню, сірка утворює стабільні сполуки з акцепторами електронів (Cl, O) (SF4, SF6, R2S+-O-, SO3).
Для сірки, як і для фосфору, слабко виражена здібність 3р-орбіталі утворювати π-зв’язки. Так, на відміну від О2, молекула S2 дуже нестійка, тому сірка утворює циклічну форму S8.
3d-орбіталі більш активні в π-перективанні.
Таким чином валентність сірки в диметилсульфоксиді займає проміжне положення між трьома та чотирма:
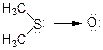
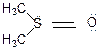
Ця сполука має тетраядричну будову. Характерно, що зв'язок S-Н менш міцний (347 кДж/моль) ніж О-Н (465 кДж/моль), тому H2S, R-SH, - більш сильні кислоти, ніж відповідні кисеньвмісні аналоги (на 6-7 порядків).
Група S-Н називається меркаптогрупою (або тіоловою). Сполуки, що містять SH-групу називають меркаптанами або тіолами (метилмеркаптан, метилтіол):
CH3-S-C2H5 метилетилсульфід
етилтіометан
Меркаптани важко розчинні у воді, добре розчинні в органічних розчинниках.
Нижчі представники – рідини, вищі тверді речовини; мають неприємний запах, їх додають як одорант до природного газу.
| Сірковмісні сполуки | Кисеньвмісний аналог | |||||||||||
| H-S-H сірководень | H-O-H | |||||||||||
| R-S-H тіоли | R-OH спирт | |||||||||||
R-C-OH
S тіонкарбонова кислота | O
OH карбонова кислота |
5. Методи добування:
а) з галогенпохідних

б) 
в) із спиртів
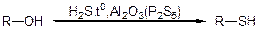
г)
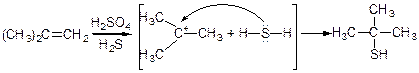
Природне походження:
Алкілсульфіди:
1)
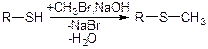
2)
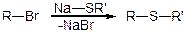
Дисульфіди:
М’яке окислення меркаптанів:
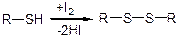
Сполуки двовалентної сірки дуже легко окислюються:
а) 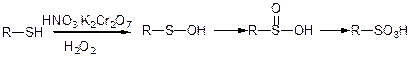
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 737; Нарушение авторских прав?; Мы поможем в написании вашей работы!


 R-C
R-C