
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ланцюга
|
|
|
|
Ланцюга,
Ланцюга,
Утворення активного центру,
Кінетичний ланцюг – це число хімічних актів приєднання, збуджених активною часточкою, наприклад радикалом. Цей процес супрводжується приєднанням мономеру до активного центру, що спричиняє ріст матеріального ланцюга –.
Довжина кінетичного та матеріального ланцюгів може бути залежно від механізма та умов полімеризації.
Полімеризацію спричиняють первинні активні центри, що утворюються при введенні в систему спеціальних речовин – (каталізаторів) або в результаті впливу певних фізичних факторів (наприклад, при опромінюванні мономеру).
Реакція, зворотня полімеризації, називається деполімеризацією.
Вона також є ланцюговою.
2. Радикальна полімеризація
|
Активними центрами радикальної полімеризації є вільні радикали – відносно стабільні
 Характерною ознакою вільних радикалів є висока активність і короткочасне існування, що зумовлює їх широке використання для синтезу полімерів.
Характерною ознакою вільних радикалів є висока активність і короткочасне існування, що зумовлює їх широке використання для синтезу полімерів.
2.1. Ініціювання радикальної полімеризації
Ініціювання полімеризації відбувається під впливом, які утворюються при термічному, фотохімічному чи радіаційно-хімічному впливу на мономер, або під впливом ініціаторів.
Цей процес характеризується значною енергією активації і невеликою швидкістю.
Термічне ініціювання стає помітним при температурах близьких до 100 оС.

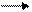 2 С6Н5CН=СН2 [ C6H5– · CH– · CH2 + · CH2- · CH–C6H5]
2 С6Н5CН=СН2 [ C6H5– · CH– · CH2 + · CH2- · CH–C6H5]
 H2C=CH–C6H 5
H2C=CH–C6H 5
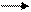 C6H5 - · CH–CH2-CH2- · CH–C6H5
C6H5 - · CH–CH2-CH2- · CH–C6H5

Радикали також утворюються при опромінюванні мономерів УФ-світлом за такою схемою:
М + hν → М* → R1 · + R2 ·
Під дією радіоактивного опромінення:
X → e − + X·+
Y + e − → Y·−
|
 |
В якості ініціаторів можуть виступати гідрогенпероксиди, пероксиди алкілів, ацилів, азо- та діазосполуки.

У загальному вигляді реакцію ініціювання можна виразити рівняннями:
|
RO· + M → ROM·,
де RO · –
М –
ROМ · –

“Ефект клітки”
Лімітуючою стадією ініціювання є утворення первинних радикалів. Не всі первинні радикали, які утворюються, беруть участь в ініціюванні.
Дія частки цих радикалів () по відношенню до загального числа первинних радикалів () називається ініціювання (f).
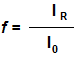 |
2.2. Ріст ланцюга
Реакція росту ланцюга полягає у взаємодії активного макрорадикала з π-зв’язком мономеру, в результаті чого утворюється новий
С-С зв’язок, а неспарений електрон локалізується на Карбону мономеру, що приєднався.
Ріст ланцюга характеризується енергією активації і швидкістю.
У загальному вигляді:
~МnМ· + M → ~Mn+1М·

|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 693; Нарушение авторских прав?; Мы поможем в написании вашей работы!