
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розрахунок ізотонічних концентрацій розчинів неелектролітів на основі газових законів
|
|
|
|
Способи розрахунку ізотонічних концентрацій.
· На основі газових законів Вант-Гофа, Авогадро, Жерара, за рівнянням Мендєлєєва – Клапейрона.
· Фармакопейний: із використанням ізотонічних еквівалентів а натрієм хлоридом.
· Кріоскопічний: за законом Рауля.
· Графічні.
За законом Авогадро та Жерара
1г/моль при 0ºС або 273ºК при тиску в 1 атмосферу або 760 мм.рт. ст. займає об’єм 22,4 л.
Для отримання осмотичного тиску, що дорівнює осмотичному тиску сироватки крові, що дорівнює 7,4 атмосфери, необхідно 1 г/моль розчинити в меншій кількості води:
22,4: 7,4 = 3,03 л.
Але враховуючи, що тиск зростає пропорційно абсолютній температурі (273ºК), необхідно внести поправку на температуру тіла людини
273ºК + 37ºК = 310ºК
Відповідно для збереження в розчині осмотичного тиску в 7,4 атмосфери 1 г/моль речовини слід розчинити не в 3,03 л розчинника, а в більшій кількості розчинника.
Із 1 г/моль речовини, що не дисоціює можна приготувати розчин
3,03 л – 273 К
Х л -- 310 К Х =  = 3,44 л
= 3,44 л
Але в аптечних умовах доцільно вести розрахунки на 1 л розчину
1 г/моль - 3,44 л
Х г/моль -- 1 л Х = 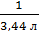 = 0,29 г/моль.
= 0,29 г/моль.
Відповідно для приготування 1 л ізотонічного розчину будь-якої лікарської речовини (неелектроліту) необхідно взяти 0,29 г/моль лікарської речовини, розчинити у воді та довести водою до 1 л:
m = 0.29 * M або 0,29 =  ,
,
де m – кількість речовини, що необхідна для приготування 1 л ізотонічного розчину, г;
0,29 – фактор ізотонії речовини-неелектроліту;
М – молекулярна маса даної лікарської речовини.
Приклад. Нехай необхідно розрахувати ізотонічну концентрацію розчину глюкози. Молекулярна маса глюкози складає 180,18.
На 1 л ізотонічного розчину потрібно глюкози:
m = 0.29 *M = 0.29 * 180.18 = 52.22 г/л.
Відповідно ізотонічна концентрація глюкози складає 5,22%.
Залежність між осмотичним тиском, температурою, об’ємом та концентрацією в розведеному розчині неелектроліту можна також виразити рівнянням Мендєлєєва – Клапейрона:
PV = nRT,
Де P – осмотичний тиск плазми крові (7,4 атм),
V – об’єм розчину, л;
n – число грам-молекул розчиненої речовини;
R – газова постійна, виражена для даного випадку в атмосферо-літрах (0,082);
T – абсолютна температура тіла (310 К).
Звідси, n = 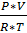 ; n =
; n = 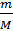 ; тоді
; тоді 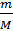 =
=  або m =
або m =  =
= 
або m = 0.29 * M
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 319; Нарушение авторских прав?; Мы поможем в написании вашей работы!