
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекція 15. Ненасичені вуглеводні
|
|
|
|
План
1. Властивості, добування та застосування алкенів.
2. Алкіни. Їх властивості, добування та використання.
1. Властивості, добування та застосування алкенів.
Алкени, алкіни належать до ненасичених органічних сполук. Ненасиченими називаються сполуки, молекули яких містять атоми вуглецю, сполучені подвійними і потрійними зв`язками.
Алкени - вуглеводні, в молекулах яких є один подвійний зв`язок між атомами
вуглецю 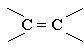 Алкени називають також олефінами, або етиленовими вуглеводнями.
Алкени називають також олефінами, або етиленовими вуглеводнями.
Етилен. Найпростішим алкеном є етилен С2Н4. За міжнародною номенклатурою назва етелену - етен. Структурна формула молекули етелену має такий вигляд:
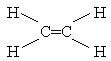
Розглянемо природу зв`язків у молекулі С2Н4 з позицій сучасної електронної теорії. В атомі вуглецю, який перебуває в збудженому стані (С*1s2 2s1 2p3), гібридизації можуть зазнавати не всі, а тільки три орбіталі зовнішнього рівня: одна s- і дві р- орбіталі. Третя р- орбіталь з неспареним електроном залишається незмінному вигляді.
Такий тип гібридизації (sp2 - гібридізація) спостерігається при утворенні молекули етилену С2Н4.
Подвійний зв`язок у молекулі етилену складається з одного s- і одного p- зв`язків. Подвійний зв'язок міцніший від одинарного, але не в два рази. Зв'язки s- і p - різняться за міцністю, більш стійкий o - зв¢язок. У структурних формулах s - і p - зв’язки зображають однаково (рискою), проте слід пам’ятати про різну природу і міцність цих зв’язків.
Гомологи етилену. Етилен С2Н4 - перший член гомологічного ряду алкенів. Послідовно додаючи до формули гомологічну різницю СН2 можна одержати формули гомологів етилену: С3Н6, С4Н8, С5Н10 і т.д. Загальна формула вуглеводнів ряду алкенів С п Н2 п, де п = 2, 3, 4….
Назви алкенів за міжнародною номенклатурою утворюють з назв алканів з такою самою кількістю вуглецевих атомів, замінюючи закінчення -ан на -ен, наприклад, етан С2Н6 -етен С2Н4, пропан С3Н8 - пропен С3Н6, бутан С4Н10 - бутен С4Н8.
Для найпростіших алкенів поширені також тривіальні назви, наприклад: етилен (етен), пропілен (пропен), бутилен (бутен).
Алкени утворюють радикали. Назва радикала складається з назви відповідного і суфікса -іл; для радикалів найпростіших акенів використовують тривіальні назви, наприклад:

Ізомерія. Для алкенів характерні два види ізомерії. Структурна ізомерія пов’язана з різним положенням подвійного зв¢язку у вуглеводневому ланцюгу і з розгалуженням ланцюга. Наприклад, бутен має такі ізомери:

Назви алкенів утворюють так. Вибирають найдовший вуглеводневий ланцюг, який містить подвійний зв’язок. Нумерують атоми вуглецю в цьому ланцюгу, починаючи з того кінця, до якого ближче розміщений подвійний зв¢язок. Приклади:

За основу назви ізомеру беруть назву алкену, що відповідає головному ланцюгу. Наприклад, бутен, якщо головний ланцюг містить 4 атоми вуглецю, пентен - 5 атомів С, октен - 8 атомів С.
У назві алкену перед коренем зазначають бічні замісники (радикали), перед якими ставлять цифру, що вказує їх положення. Після кореня записують номер вуглецевого атома (найменший), біля якого знаходиться подвійний зв’язок. Отже, алкени в наведених вище прикладах мають такі назви:

Другий характерний вид ізомерії вуглеводнів з подвійним зв¢язком - це просторова ізомерія, або стереоізомерія. Вона зумовлена різним положенням замісників відносно площини, в якій розміщені подвійні зв’язки. Для позначення стереоізомерів алкенів використовують префікси цис- і транс-. Наприклад, бутен-2 має такі стереоізомери:

У молекулі цис - ізомеру алкільні радикали розміщені по один бік від площини подвійного зв’язку, в молекулі транс - ізомеру по різні боки. Перехід від цис - бутену-2 до транс - бутену-2 і навпаки можливий тільки під час розриву p- зв’язку між вуглецевими атомами.
Цис - і транс - ізомери різняться за властивостями. Наприклад, температура кипіння цис - бутену-2 дорівнює 3,70С, а транс -бутену-2 - +10С.
Сполуки з подвійним зв'зком вуглець - вуглець можуть мати циклічну будову. Ці сполуки належать до циклоалкенів.
Циклоалкени не є гомологами етилену.
Властивості. Етен, пропен і бутени- безбарвні гази. Алкени нормальної будови від С5Н10 до С18Н36 - рідини, а починаючи з С19Н38 - тверді речовини.
Алкени мало розчинні у воді, густина їх менша від 1г/см3.
На відміну від алканів етилен і його гомологи виявляють високу реакційну здатність, що зумовлено наявністю в їхніх молекулах подвійного зв¢язку. Алкени здатні вступати в реакції приєднання за рахунок розриву p-зв¢язку. Крім того, p-зв¢язок під дією окислювачів руйнується легше, ніж s - зв¢язок, тому для алкенів характерна участь у ролі відновників в окислювального відновних реакціях.
1. Гідрування. Приєднуючи водень, алкени переходять у алкани:

Реакції гідрування алкенів відбуваються при наявності каталізаторів(платини, паладію, нікелю).
2. Галогенування. Алкени легко приєднують галогени, особливо хлор і бром:
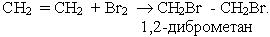
На цієї реакції базується якісне визначення ненасичених сполук: бромна вода під час пропускання крізь неї етилену та інших алкенів знебарвлюється.
3. Гідрогалогенування. Галогеноводні також легко приєднуються до алкенів, наприклад:
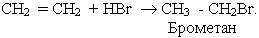
Ця реакція є гетеролітичною, що відбувається з утворенням іонів в результаті гетеролітичного розриву подвійного зв’язку. Подвійний зв’язок має підвищену електронну густину, тому він легко приєднує електрофільні частинки.
Молекула НВr може відщеплювати іон водню Н+, який виступає як електрофільна частинка. Іон водню взаємодіє з молекулою етилену, при цьому утворюється органічний катіон, який далі реагує з бромід-іонами:
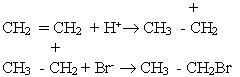
Приєднання галогеноводнів до гомологів етилену може відбуватися двома шляхами, наприклад:

Підчас цієї реакції утворюється переважно 2-бромпропан. Вивчення подібних реакцій дало змогу російському хіміку В.В.Марковникову сформулювати таке правило: атом водню галогеноводнів та інших несиметричних водневих сполук приєднується до найбільш гідрогенізованого атома вуглецю біля подвійного зв’язку (тобто до атома вуглецю, який сполучений з великою кількістю атомів водню).
4. Гідратація. Підчас гідратації алкенів при наявності каталізаторів (сірчаної кислоти або інших) утворюються спирти; приєднання води до гомологів етилену відбувається згідно з правилом Марковникова, наприклад:
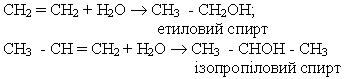
5. Алкілування. Алкени можуть приєднувати насичені вуглеводні з утворенням вищих алканів. Реакції алкілування відбуваються при наявності каталізаторів (АlCІ3, AlBr3, HF, H2SO4). Наприклад, підчас взаємодії етилену з пропаном утворюються два нових алкани:

6. Полімеризація. Молекули алкенів можуть сполучатися одна з одною з утворенням макромолекул з розімкненням p-зв¢язку.
7. Окислення. Алкени легко окислюються, причому залежно від сили окислювачів реакції можуть відбуватися з розривом тільки p-зв¢язку або з повним розривом подвійного зв¢язку.
Перманганат калію в нейтральному і слабко лужному середовищах окислює алкени з розімкненням p-зв¢язку. Цю реакцію можна зобразити схемою:
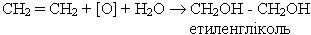
Якщо алкени пропускати крізь водний розчин перманганату калію, то відбуватиметься знебарвлення розчину. Цю реакцію, як і реакцію бромування, використовують для якісного визначення алкенів.
Сильні окислювачі (перманганат калію або дихромат калію при наявності сірчаної кислоти) окислюють алкени з розривом молекули за місцем подвійного зв¢язку. В результаті утворюються різні кисневмісні органічні сполуки, наприклад:
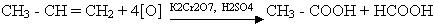
Підчас високотемпературного окислення алкенів у кисні або на повітрі вони згоряють:
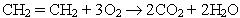
В результаті завжди утворюються оксид вуглецю (ІV) і вода.
Добування. Лабораторним способом добування етилену та його гомологів є дегідратація (відщеплення води) спиртів при наявності концентрованої сірчаної кислоти чи інших водовідбирних агентів. Так, етилен можна добути з етиленового спирту при нагріванні його з сірчаною кислотою:

Алкени можна добути з галагенопохідних алканів дією на них спиртового розчину лугу, наприклад:

У промисловості алкени добувають з насичених вуглеводнів під час термічного розкладання (крекінгу) нафти, наприклад:
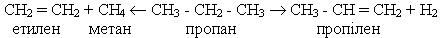
Інший промисловий спосіб добування алкенів базується на дегідруванні (відщеплення водню) алканів при наявності каталізаторів, наприклад нікелю:

Застосування. Етилен та інші алкени є важливою сировиною для хімічної промисловості. З етилену і пропілену виробляють пластмаси - поліетилен і поліпропілен. Етилен є вихідною речовиною для промислового добування багатьох органічних речовин.
Алкілуванням алкенів добувають насичені вуглеводні, які використовують як моторне паливо.
Етилен прискорює достигання деяких плодів, для чого його вводять в атмосферу сховищ, де знаходяться недостиглі овочі та фрукти. Етилен також запобігає передчасному скиданню плодів рослинами в теплицях.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2078; Нарушение авторских прав?; Мы поможем в написании вашей работы!