
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Алкіни. Їх властивості, добування та використання
|
|
|
|
Алкіни - вуглеводні, в молекулах яких є два атоми вуглецю, сполучені потрійним зв'язком - С º С -. Алкіни називають також ацетиленовими вуглеводнями.
Найпростішім алкіном є ацетилен, або етин:
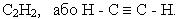
Розглянемо природу зв¢язків у молекулі ацетилену згідно з електронною теорією. Підчас утворення хімічних зв¢язків у молекулі ацетилену гібридизації зазнають тільки дві орбіталі зовнішнього енергетичного рівня атома вуглецю: одна s- і одна р- орбіталь. Цей тип гібридизації називається sp-гібридизацією. Дві р- орбіталі вуглецевого атома залишаються в незмінному вигляді.
Потрійний зв¢язок у молекулі ацетилену складається з одного s- і двох p- зв¢язків. Постійний зв’язок міцніший, ніж подвійний, а відстань між вуглецевими атомами в ацетилені менша, ніж в етилені.
Ацетилен С2Н2 - перший член гомологічного ряду. Формули наступних алкінів одержують додаванням до формули ацетилену гомологічної різниці СН2: С3Н4, С4Н6 і т.д.
Назви алкінів за міжнародною номенклатурою утворюють з назв алканів з тим самим числом атомів вуглецю, замінюючи закінчення -ан на -ін (-ин). Приклади:

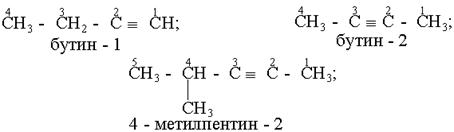
Назви алкінів з розгалуженим ланцюгом і структурних ізомерів алкінів, які утворюються внаслідок різного положення потрійного зв¢язку в ланцюгу і бічних замісників, будують аналогічно до назв складних алкенів; цифра в кінці назви означає найменший номер атома вуглецю ланцюга, який находиться біля потрійного зв¢язку.
Приклади:
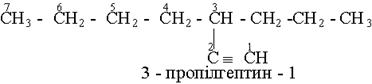
Загальна формула гомологічного ряду алкінів СnН2n -2 -, де п = 2,3,4,5….
Властивості. Ацетилен - це безбарвний газ без запаху, температура кипіння - 83,8°С. Розчинний у воді. Технічний ацетилен має неприємний запах, зумовлений наявністю домішок.
Як і алкени, ацетилен легко вступає в реакції приєднання і окислення. Крім того, для алкінів характерні реакції заміщення водню, сполученого з атомом вуглецю біля потрійного зв'язку.
1. Гідрування. Алкіни приєднують водень при наявності каталізаторів з утворенням алканів або алкенів (неповне гідрування). Так, якщо як каталізатор застосовують нікель або платину, то при гідруванні ацетилену утворюється насичена сполука етан, а з каталізатором паладій або залізо - етилен:
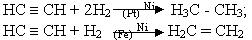
2. Галогенування. Алкіни легко приєднують хлор і бром. Реакція відбувається в дві стадії:
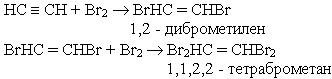
Як і етилен, ацетилен знебарвлює бромну воду. Ця реакція є якісною на ацетилен на інші алкіни.
3. Гідрогалогенування. Процес приєднання галогеноводнів до алкінів відбувається легко в дві поділимі стадії. На першій стадії утворюється галагенопохідна алкену, на другій до цієї похідної приєднується друга молекула галогеноводню згідно з правилом Марковникова:
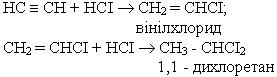
4. Гідратація. Ацетилен та його гомологи гідратуються при наявності каталізаторів - солей ртуті (ІІ) HgSO4 або Hg(NO3)2. При гідратації ацетилену утворюється оцтовий альдегід:
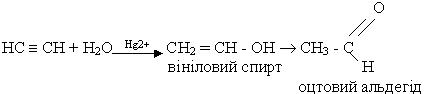
Взаємодія відбувається через стадію утворення нестійкої сполуки - вінілового спирту, який піддається изомерізації в стійку сполуку - оцтовий альдегід. Цю реакцію відкрив російський вчений М.Г.Кучєров у 1881 р. Вона лежить в основі промислового добування оцтового альдегіду.
5. Окислення. Алкіни легко окислюються. Так, вони знебарвлюють розчин перманганату калію:
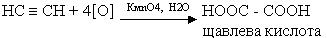
Цю реакцію використовують як якісну на потрійний зв’язок.
6. Реакції заміщення. Водень, сполучений з атомом вуглецю біля потрійного зв'язку, дуже рухливий, внаслідок чого для ацетилену та його гомологів характерні реакції заміщення. Наприклад, ацетилен та його гомологи які містять потрійний зв’язок біля першого атома вуглецю, взаємодіють з аміачними розчинами гідроксидів або солей срібла і міді (І):
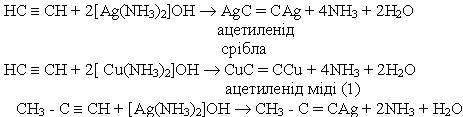
До похідних ацетилену ацетиленідів металів - належить карбід кальцію СаС2 структура якого містить потрійні зв’язки вуглець - вуглець.
Добування. Для добування ацетилену в лабораторних умовах використовують реакцію карбіду кальцію з водою:
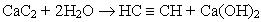
У промисловості ацетилен добувають з технічного карбіду кальцію або метану при нагріванні:

Гомологи ацетилену можна добути з дигалогенопохідних алканів, діючи на них спиртовим розчином лугу, наприклад:
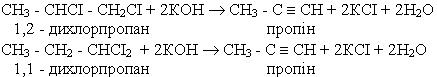
Застосування. Ацетилен є вихідною сировиною для багатьох органічних синтезів. У хімічній промисловості його застосовують для добування оцтового альдегіду і оцтової кислоти, вінілхлориду та інших речовин.
Ацетилен використовують для автогенного зварювання і різання металів, він згоряє в кисні, виділяючи велику кількість теплоти (температура полум'я досягає 3500°С).
Література
Основна література.
57. Глінка М.Г., Загальна хімія. – К.: Вища школа, 1982. – 607 с.
58. Рейтер Л.Т., Степаненко О.М., Басов В.П., Теоретичні розділи загальної хімії. Київ.: „Каравела”, 2003. – 342 с.
59. Сегеда А.С. Аналітична хімія. Якісний і кількісний аналіз. К.: ЦУЛ, 2003. –311с.
60. Логинов Н.Я. Аналитическая химия. /Логинов Н.Я., Воскресенський А.Г., Солодкин, И.С./ – М.: “Просвещение”, 1975. – 477с.
Додаткова література.
61. Басов В.П., Родіонов В. М. „Хімія”. Київ.: „Каравела”, 2004. – 318 с.
62. Омелян В.І, Шешеня С.К. Навчальний комплекс з дисципліни хімія і методи дослідження сировини та матеріалів. Частина I. загальні основи аналітичної хімії. Для віртуально-тренінгової технології самостійної роботи студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”, 7.00503.02 “Товарознавство та експертиза в митній справі”. – Полтава: РВВ ПУСКУ, 2002. – 179.
63. Омелян В.І. Опорний конспект лекцій з дисципліни хімія і методи дослідження сировини та матеріалів. Частина I. Загальні основи аналітичної хімії для студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”,7.0503.02 “Товарознавство та експертиза в митній справі” та МІПК. – Полтава: РВВ ПУСКУ, 2003. – 60.
64. Омелян В.І., Зайцева І.В. Хімія і методи дослідження сировини та матеріалів: Методичні рекомендації. Частина 1. Методичні рекомендації до самостійної роботи студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”,7.0503.02 “Товарознавство та експертиза в митній справі”. –Полтава: РВВ ПУСКУ, 2004. – 23 с.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 30351; Нарушение авторских прав?; Мы поможем в написании вашей работы!