
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Формальдегид – газ. Альдегиды С2-С13 – жидкости, выше – твердые вещества
|
|
|
|
Физические свойства
Формальдегид – газ. Альдегиды С2-С13 – жидкости, выше – твердые вещества. Кетоны только жидкие и твердые. Температура кипения гораздо ниже, чем у соответствующих спиртов. Причина этого – отсутствие водородных связей. Низшие растворяются в воде неограниченно, с повышением молекулярного веса растворимость уменьшается. Альдегиды обладают фруктовым запахом. В инфракрасном спектре альдегидов и кетонов наблюдается характерная очень интенсивная полоса поглощения V(CO) 1700 см-1 валентных колебаний группы С=О.
Альдегиды и кетоны отличаются высокой реакционной способностью, обусловленной наличием полярной группы С=О. Наиболее типичными реакциями альдегидов и кетонов являются реакции нуклеофильного присоединения.
Значительная часть реакций альдегидов и кетонов идет также за счет наличия подвижных атомов водорода в 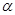 -положении к группе С=О.
-положении к группе С=О.
I. Реакции присоединения и замещения.
Протекают в основном по нуклеофильному механизму.
1) Реакция присоединения HCN начинается атакой нуклеофильных агентов ионов С=N, источником которых является катализатор (CuCN)
O - O- OH -
CH3-C + CN  CH3-C-CN
CH3-C-CN 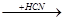 CH3-C-CN + CN
CH3-C-CN + CN
H H H
Окситрил
2) Взаимодействие с бисульфатом натрия
CH3 O CH3 O
H-C-S-ONa 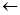 H-C +:S-ONa
H-C +:S-ONa
OH O: HO
 -
-
натриевая соль
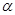 -оксиэтилсульфокислоты
-оксиэтилсульфокислоты
Это кристаллическое вещество в органических растворителях выпадает в осадок. Реакция используется для выделения альдегидов и кетонов из реакционных смесей. После отделения бисульфатные соединения разлагаются добавлением кислоты.
СH3CHOH-SO2ONa + HCl  NaCl + H2O + SO2 + CH3-C-H
NaCl + H2O + SO2 + CH3-C-H
O
3) Присоединение воды
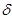 -
-
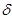 +O.. OH
+O.. OH
H-C + HOH 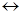 H-C-OH
H-C-OH
H OH
При попытке выделения этих веществ из водного раствора они отщепляют воду и превращаются в альдегид. Активность карбонильных соединений изменяется в следующем порядке:
O O O O
CCl3-C > H-C > R-C > R-C
H H H R
Такой ряд активности характерен и для других реакций нуклеофильного присоединения.
4) Взаимодействие со спиртами
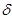 -
-
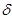 +O.. OH OC2H5
+O.. OH OC2H5
СH3-C + HOC2H5  CH3-C-OC2H5
CH3-C-OC2H5  H2O + CH3-C-OC2H5
H2O + CH3-C-OC2H5
H H H
Ацетальдегид полуацеталь диэтилацеталь
(моноэтилацеталь)
В эту реакцию вступают только альдегиды.
Ацетали – нерастворимые в воде жидкости приятного фруктового запаха.
5) Взаимодействие с магнийорганическими соединениями (см. получение спиртов).
6) Взаимодействие с аммиаком и его производными.
а) взаимодействие альдегидов с аммиаком
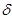 -
-
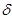 +O H H
+O H H
CH3-C + NH3  CH3-C- NH2
CH3-C- NH2  H2O + CH3-C
H2O + CH3-C  полимеризация
полимеризация
H OH NH
б) взаимодействие с гидроксиламином приводит к образованию оксимов
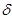 +.. NHOH
+.. NHOH
CH3-C=O + NH2OH  CH3-C-OH
CH3-C-OH  H2O + CH3-C=N-OH
H2O + CH3-C=N-OH
CH3 CH3 CH3
неустойчивый
оксиамин
в) взаимодействие с гидразином и его замещенными производными приводит к образованию гидразонов
O
СH3-C + NH2-NH2  H2O + CH3-CH=N-NH2
H2O + CH3-CH=N-NH2  N2 + CH3-CH3
N2 + CH3-CH3
H
Гидразин гидразон
Реакция была использована Кижнером для восстановления альдегидов или кетонов до углеводородов, т.к. оказалось, что при нагревании в присутствии КОН гидразоны отщепляют азот.
Реакция с фенилгидразином используется как качественная на карбонильное соединение.
O
СH3-C + NH2-NH-C6H5  H2O + CH3-CH=N-NH-C6H5
H2O + CH3-CH=N-NH-C6H5
H
Фенилгидразин фенилгидразон
(оранжевого цвета)
5) взаимодействие с PCl5 (см. получение галогенопроизводных)
II. Реакции полимеризации и конденсации
1)Реакции полимеризации – дают только альдегиды
а) образование линейных полимеров
O
Формальдегид H-C при стоянии в водных растворах
H
полимеризуется с образованием линейного полимера – параформа, содержащего несколько десятков молекул полимера.
O H H H
Н-С  -С-O-(C-O)x-2
-С-O-(C-O)x-2  C-O-
C-O-  CH2-O-(CH2-O)x-2-CH2
CH2-O-(CH2-O)x-2-CH2
H в среде НОН Н H H OH OH
HOH параформ
х до 100
Концевые связи насыщаются за счет присоединения молекулы воды.
б) В безводных средах образуются циклические полимеры. Уксусный альдегид в присутствии серной кислоты образует циклический тример – паральдегид.
O
CH3-CH CH-CH3
3CH3-CH=O 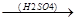 O O
O O
CH3
CH3
паральдегид
При низких температурах в эфирном растворе образуется циклический продукт соединения 4-х молекул – метальдегид. Этот кристаллический продукт применяется как твердое топливо “твердый спирт”.
2) Реакция конденсации (характерна и для альдегидов, и для кетонов)
а) альдольная конденсация протекает под действием слабых оснований
O O CH2 O O
CH3-C + CH3-C 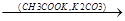 CH3-C-CH2-C
CH3-C-CH2-C  CH2-C=CH-C
CH2-C=CH-C
H H H H H
Альдоль кротоновый альдегид
б) кротоновая конденсация – продолжение альдольной. Если реакцию вести дольше, то альдоль отщепляет воду и образует непредельный альдегид или кетон. В реакцию альдольной и кротоновой конденсации могут вступать и альдегиды, и кетоны. После взаимодействия двух молекул может присоединяться третья и т.д. А.М.Бутлеров с помощью этой реакции получил сахар.
H
6СH2=O  CH2-CH-CH-CH-CH-C=O
CH2-CH-CH-CH-CH-C=O
OH OH OH OH OH
Обязательным условием способности соединения вступать в реакцию альдольной и кротоновой конденсации является наличие подвижного атома Н в 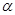 –положении к карбоновой группе.
–положении к карбоновой группе.
O
СH3-CH-C
CH3 H
вступает только в реакцию альдольной конденсации, но не дает кротоновой (нет второго подвижного атома водорода).
CH3 O
СH3-C-С триметилуксусный альдегид
CH3 H
не вступает в реакцию альдольной конденсации (нет Н в 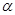 –положении).
–положении).
в) сложноэфирная конденсация (реакция Тищенко)
O O O
СH3-C + CH3-C 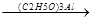 CH3-CH2-O-C-CH3
CH3-CH2-O-C-CH3
H H этилацетат
Приводит к образованию сложного эфира, т.к. идет по другому механизму. Катализатор (С2Н5О)3Al обладает электрофильными свойствами (атом Al несет положительный заряд) и способен притягиваться к неподеленной паре электронов отрицательно заряженного атома карбонильного кислорода.
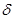 - -
- -
O 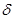 + + O-Al(OC2H5)3
+ + O-Al(OC2H5)3 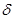 - H
- H
CH3-C + Al(OC2H5)3  CH3-C + O=C-CH3
CH3-C + O=C-CH3 
H
O-Al(OC2H5)3 O H
 CH3-C-O-C-CH3
CH3-C-O-C-CH3  CH3-C-O-C-CH3 + Al(OC2H5)3
CH3-C-O-C-CH3 + Al(OC2H5)3
H H H
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 426; Нарушение авторских прав?; Мы поможем в написании вашей работы!