
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Факторы, влияющие на скорость химических реакций
|
|
|
|
Что такое скорость химической реакции?
ОСНОВНЫЕ ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ В ПРОЦЕССЕ ТЕХНОЛОГИЧЕСКОЙ ОБРАБОТКИ
В основе ряда пищевых технологий лежат химические превращения.
Такие как получение патоки, кристаллической глюкозы путем кислотного гидролиза крахмала, различных жиров способом гидрогенизации и переэтерификации, инвертного сахара путем кислотного гидролиза сахарозы.
Этим процессам отводится важная роль на отдельных стадиях производства хлеба, мучных кондитерских изделий, сахара, шоколада, растительных масел, прессованных дрожжей, а также при хранении продуктов.
Скорость химических процессов имеет большое значение. Скоростями химических реакций и механизмами химического взаимодействия, а также влиянием различных условий на скорость химической реакции занимается раздел физической химии, который называется химической кинетикой.
Скорость химической реакции характеризуется изменением концентрации одного из реагирующих веществ в единицу времени.
При расчете скорости реакции можно рассматривать:
- одно из исходных веществ, концентрация которого в ходе реакции уменьшается, или
- один из продуктов реакции, концентрация которого в ходе реакции возрастает.
Поскольку скорость реакции всегда положительна, а изменение концентрации исходных веществ отрицательно, то в правой части уравнения ставят знак минус.
Для продуктов реакции изменение концентрации и производная концентрации положительны.
Но взаимодействующие вещества часто находятся в разных агрегатных состояниях и поэтому химические реакции могут быть гомогенными и гетерогенными.
____________
В гомогенных системах реагирующие вещества находятся в одной какой-либо фазе: газовой (Г), жидкой (Ж) или твердой (Т); в гетерогенных — в разных фазах. На практике наиболее часто встречаются следующие гетерогенные системы: Г-Ж, Г—Т, Ж—Т. В некоторых случаях такие системы могут быть трехфазными, например Г—Ж—Т, Г—Т—Т.
Давайте вспомним примеры…… из пищевых продуктов………
Реакции в гомогенных системах протекают обычно быстрее, чем в гетерогенных, механизм технологического процесса проще и управлять им легче, поэтому на производстве, если это возможно, стремятся перевести твердые вещества в жидкое состояние, например, путем растворения.
Основные факторы, влияющие на скорость всех реакций, - это концентрация реагирующих веществ, температура, наличие катализатора.
Влияние концентрации. Увеличение концентрации взаимодействующих веществ — один из самых распространенных приемов интенсификации процессов. Зависимость скорости химических реакций от концентрации определяется законом действия масс. Согласно этому закону скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степени, равной стехиометрическому коэффициенту, стоящему перед формулой вещества в уравнении реакции. Например, в производстве патоки для реакции нейтрализации хлороводородной кислоты карбонатом натрия скорость может быть вычислена по следующему уравнению:
2НСl + Na2СО3 = 2NаСl + Н2О + СО2;
(8.2)
Закон действия масс в общем записывается так:
(8.3)
где К— коэффициент пропорциональности, называемый константой скорости реакции; Сп и Сь — концентрации веществ а и Ь, участвующих в химической реакции; пит — стехиометрическис коэффициенты.
Если принять, что, то v = К, т. е. константа скорости реакции численно равна скорости реакции при концентрации реагирующих веществ, равной единице. Константа скорости зависит от природы реагирующих веществ, температуры, наличия катализатора и не зависит от концентрации веществ, участвующих в химической реакции. Константа скорости данной реакции при данной температуре постоянна.
Для определения констант скорости реакции в зависимости от молекулярности и порядка реакции выведены соответствующие формулы.
Молекулярность реакции определяется числом молекул, участвующих в элементарном акте химического взаимодействия. Если для этого требуется одна молекула, то реакции называются мономолекулярными. Примером такой реакции может служить реакция разложения СаСОз под действием высокой температуры при обжиге известняка в печах на свеклосахарных заводах:
СаСО3 = СаО + СО2.
При участии двух молекул реакции называются бимолекулярными, трех — тримолекулярными. Это могут быть молекулы одного или разных веществ. Реакция взаимодействия хлороводородной кислоты с карбонатом натрия, приведенная выше, является тримолекулярной.
Порядок реакции — это сумма показателей степеней при концентрациях веществ в уравнении закона действия масс. Скорость реакции первого порядка пропорциональна концентрации в первой степени, скорости реакций второго и третьего порядков пропорциональны соответственно концентрациям во второй и третьей степени. Однако порядок реакции может быть ниже ее молекулярности, если какое-либо вещество находится в избытке и поэтому его концентрацию можно практически считать неизменной. Например, при инверсии сахарозы в водном растворе НСl
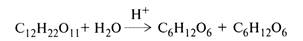 |
изменение концентрации воды так незначительно, что им можно пренебречь. Следовательно, инверсию сахарозы рассматривают как реакцию первого порядка, хотя в соответствии с молекулярностью она бимолекулярна, так как в ней участвуют две молекулы: сахарозы и воды.
Таким образом только эксперимент может установить порядок реакции и только значение порядка реакции позволяет вычислить константу ее скорости.
Для реакции первого порядка константа скорости реакции
 |
(8.4)
где а — начальная концентрация вещества; х — количество вещества, вступившее в реакцию за данный отрезок времени т; (а — х) — концентрация вещества в момент времени т.
Для реакции второго порядка константа скорости реакции
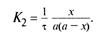 |
Знание порядка и константы скорости реакции позволяет определить оптимальное время проведения реакции.
Так, если начальная концентрация сахарозы составляет 100 %, то в 0,5 М растворе хлороводородной кислоты за 20 мин сахароза гидролизуется на 50 %. Время, необходимое для гидролиза сахарозы на 90 %, рассчитывается следующим образом. Гидролиз сахарозы — это реакция первого порядка, поэтому константа ее скорости
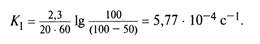 |
Время гидролиза
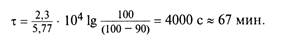 |
Влияние температуры. Температура — важный фактор, определяющий скорость реакции. С повышением температуры скорость реакции возрастает, что связано с увеличением константы скорости реакции. Согласно правилу Вант-Гоффа повышение температуры на 10 °С увеличивает скорость реакции в 2...4 раза (в среднем в 3 раза). Это правило применимо к реакциям, протекающим в области температур от 0 до 300 °С и в небольшом температурном интервале.
Если обозначить константу скорости реакции буквой К t,
температуру, при которой она протекает, t,
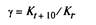 |
а константу скорости при температуре t + 10° Kt+10, то отношение этих констант является температурным коэффициентом скорости реакции:
Если принять g = 2 (максимальное значение коэффициента), то при увеличении температуры реакции на 50 °С скорость реакции увеличится в 32 раза.
Более точно влияние температуры на скорость химических реакций выражается соотношением, полученным экспериментальным путем. Эта зависимость имеет следующий вид:
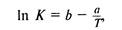 |
где Ь и а — постоянные для данной реакции; Т ' — температура, К.
Характер влияния температуры и концентрации реагирующих веществ на скорость химических реакций можно объяснить теорией активных столкновений.
По этой теории химическое взаимодействие между молекулами возможно только при их столкновении, однако к химическим реакциям приводят эффективные столкновения, т. е. в реакцию вступают не все сталкивающиеся молекулы, а только молекулы, обладающие определенной энергией, избыточной по сравнению со средней. Молекулы, обладающие такой энергией, называются активными. Избыточная энергия молекул называется энергией активации.
Для протекания химических реакций необходимо разорвать внутримолекулярные связи в молекулах реагирующих веществ. Если сталкивающиеся молекулы обладают большой энергией и ее достаточно для разрыва связей, то реакция пойдет; если энергия молекул меньше необходимой, то столкновение будет неэффективным и реакция не пойдет.
При повышении температуры количество активных молекул увеличивается, число столкновений между ними возрастает, в результате чего растет скорость реакции. С увеличением концентрации реагирующих веществ общее число столкновений, в том числе эффективных, также возрастает, в результате увеличивается скорость реакции.
Влияние катализатора. Катализатор — это вещество, которое резко изменяет скорость реакции. В присутствии катализаторов реакции ускоряются в тысячи раз, могут протекать при более низких температурах, что экономически выгодно. Велико значение катализаторов в органическом синтезе — в процессах окисления, гидрирования, дегидрирования, гидратации и др. Чем активнее катализатор, тем быстрее идут каталитические реакции. Катализаторы могут ускорять одну реакцию, группу реакций или реакции разных типов, т. е. они обладают индивидуальной или групповой специфичностью, а некоторые из них пригодны для многих реакций. Например, ионы водорода ускоряют реакции гидролиза белков, крахмала и других соединений, реакции гидратации и т. д. Существуют каталитические реакции, в которых катализатором является один из промежуточных или конечных продуктов реакции. Эти реакции идут с малой скоростью в начальный период и с возрастающей — в последующий.
Катализаторами преимущественно служат металлы в чистом виде (никель, кобальт, железо, платина) и в виде оксидов или солей (окись ванадия, окись алюминия), соединения железа, магния, кальция, меди и т. п. Неорганические катализаторы термостабильны, и реакции с ними протекают при сравнительно высоких температурах.
В среде, где протекает реакция, всегда находятся и посторонние вещества. Это обстоятельство оказывает на катализатор различное действие: одни из них нейтральны, другие усиливают действие катализатора, третьи его ослабляют или подавляют. Вещества, отравляющие катализатор, называются каталитическими ядами.
Есть понятие катализ гомогенный или гетерогенный. В гетерогенном катализе реагирующие вещества обычно находятся в жидком или газообразном состоянии, а катализатор — в твердом, при этом реакция протекает на границе двух фаз, т. е. на поверхности твердого катализатора.
Например, каталитическая реакция гидрирования жиров — трехфазная: катализатор - металлический никель — образует твердую фазу, водород — газообразную, а жир — жидкую. Поэтому в данном случае речь идет о гетерогенном катализе.
При гетерогенном катализе большое значение имеют способ получения катализатора, условия проведения процесса, состав примесей и т. д. Катализаторы должны обладать значительной селективностью, активностью и сохранять эти свойства длительное время.
Механизм гомогенного катализа объясняют теорией промежуточных соединений. При внесении катализатора реакция проходит через несколько промежуточных стадий, требующих меньшей энергии активации, чем прямая реакция без катализатора, что приводит к колоссальному возрастанию скорости реакции.
Медленно протекающий процесс, например реакция
А + В = АВ,
в присутствии катализатора К происходит в две стадии: А + К = АК (промежуточное соединение); АК + В = АВ + К.
Каждая из этих стадий идет с малой энергией активации и, следовательно, с большой скоростью. Катализатор образует промежуточное соединение, которое при взаимодействии с другим веществом регенерирует катализатор.
Многие гомогенные реакции катализируются действием ионов Н+ и ОН~. К таким реакциям относятся инверсия сахарозы, гидролиз сложных эфиров, в том числе жиров. Ионы металлов катализируют реакции окисления, гидролиза. Например, медь катализирует окисление аскорбиновой кислоты, поэтому оборудование для переработки плодов и овощей нельзя изготавливать из меди и ее сплавов. Окисление пищевых жиров ускоряется под действием ионов меди, железа, марганца, поэтому жиры нельзя хранить в металлической таре.
Основной недостаток гомогенного катализа - трудно выделить катализатор из конечной смеси (жидкости или газа).
От этого часть его безвозвратно теряется, а продукт загрязняется им.
При гетерогенном катализе такого не бывает, и это основная причина его широкого использования в промышленности. Этот вид катализа сопровождается образованием промежуточных соединений. Они формируются на отдельных участках поверхности катализатора, в так называемых активных центрах, занимающих небольшую часть его поверхности.
Если активные центры блокировать, например, каталитическими ядами, то катализатор теряет свою активность. Для увеличения поверхности и, следовательно, количества активных центров катализатора его измельчают. Чтобы катализатор не уносился током газа, его наносят на инертный носитель с развитой поверхностью (силикагель, асбест, пемзу и т. п.).
Большинство каталитических реакций положительно, т. е. в присутствии катализатора их скорость возрастает. Однако встречается отрицательный катализ, когда катализатор замедляет скорость реакции. В данном случае катализатор называют ингибитором. Если ингибитор тормозит процесс окисления, его называют антиокислителем или антиоксидантом.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 2564; Нарушение авторских прав?; Мы поможем в написании вашей работы!