
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 12. Химическое равновесие
|
|
|
|
При постоянной температуре скорость гомогенной реакции прямо пропорциональна произведению концентраций реагирующих веществ (причем концентрации берутся в степенях, равных коэффициентам перед формулами веществ в уравнении реакции).
Например, для гомогенной реакции:
nA + mB ® D
закон действующих масс (то есть выражение скорости реакции) имеет вид: 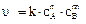 или
или 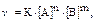
где υ - скорость гомогенной реакции,
сА и сВ – концентрации веществ А и В (моль/л),
k – коэффициент пропорциональности, он называется константой скорости реакции, которая характеризует реакционную способность реагирующих веществ.
Из уравнения 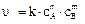 следует, что если СА = СВ = 1 моль/л, то k = υ, то есть константа скорости реакции (k) численно равна скорости реакции (υ), когда концентрации реагирующих веществ равны 1 моль/л.
следует, что если СА = СВ = 1 моль/л, то k = υ, то есть константа скорости реакции (k) численно равна скорости реакции (υ), когда концентрации реагирующих веществ равны 1 моль/л.
Величина константы скорости k зависит:
1) от природы реагирующих веществ;
2) от температуры (с повышением температуры значение k увеличивается);
3) от присутствия катализатора.
Величина константы скорости k не зависит от концентрации реагирующих веществ.
Для гетерогенной реакции, например:
С(тв) + О2(г) ® СО2(г)
выражение скорости реакции будет иметь вид:
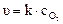
При этом концентрация твердого углерода будет практически постоянной величиной, поэтому на скорость реакции влиять не будет и поэтому в выражение скорости реакции не входит.
3. Зависимость скорости реакции от температуры. Энергия активации
При повышении температуры скорость большинства реакций увеличивается. Зависимость скорости реакции от температуры можно изобразить на графике:
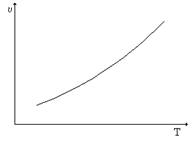
Однако некоторые реакции с увеличением температуры замедляются, например, реакции с участием ферментов. При повышении температуры фермент уменьшает свою каталитическую активность, поэтому скорость реакции тоже уменьшается.
Зависимость скорости реакции от температуры можно выразить с помощью приближенного правила Вант-Гоффа (1884 г.), которое гласит:
При повышении температуры на каждые 10° скорость большинства реакций увеличивается в 2 – 4 раза, то есть:
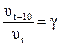 ,
,
где υt – скорость реакции при температуре t;
υt+10 – скорость реакции при температуре t + 10, то есть на 10° больше;
g - температурный коэффициент скорости реакции (он показывает во сколько раз возрастает скорость реакции (или константа скорости) при повышении температуры на 10°.
Если температура повысилась не на 10°, а изменилась с t1 до t2, то правило Вант-Гоффа записывается так:
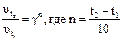
Отсюда:
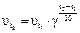
Правило Вант-Гоффа – приближенное правило. Точную зависимость константы скорости реакции (k) от температуры (Т) выражает уравнение Аррениуса (1889 г.):
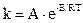 ,
,
где А – постоянная величина для данной реакции;
e – основание натурального логарифма;
R – 8,314 Дж/моль×К – газовая постоянная;
Е – энергия активации реакции.
Уравнение Аррениуса можно записать в логарифмической форме:
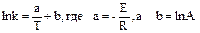
Из уравнения Аррениуса следует, что с увеличением температуры (Т) значение константы скорости (k) увеличивается. И, наоборот, чем больше энергия активации реакции (Е), то есть, чем выше энергетический барьер, тем меньше значение k.
В 1889 г. Аррениус создал теорию активных (эффективных) столкновений (соударений). По этой теории к химическому взаимодействию будут приводить лишь столкновения активных частиц, то есть частиц (молекул, ионов и др.), которые в момент столкновения друг с другом обладают некоторым избытком энергии по сравнению со средней энергией всех исходных частиц реагирующих веществ. Этот избыток энергии активных частиц (по сравнению со средней энергией всех частиц) называется энергией активации, которая входила в уравнение Аррениуса (см. выше).
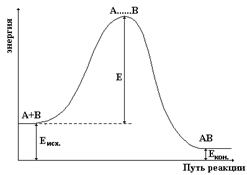
На рисунке на оси ординат отложена потенциальная энергия системы, а по оси абсцисс отложен путь реакции, то есть превращение исходных веществ А и В в продукты реакции АВ.
Еисх. – средняя энергия всех исходных частиц А и В;
Екон. – средняя энергия частиц АВ, то есть продукта реакции;
Е – энергия активации реакции.
Из рисунка видно, что превращение исходных веществ А и В в продукт реакции АВ протекает через энергетический барьер. Только те молекулы А и В могут перейти в продукт АВ, которые в состоянии преодолеть этот энергетический барьер, то есть обладают избытком энергии, равной или большей, чем энергия активации.
Таким образом, энергия активации (Е) – это энергетический барьер, который отделяет исходные вещества А и В от продукта реакции АВ.
Чем больше энергия активации (Е) реакции, то есть больше высота энергетического барьера, тем меньше скорость реакции и константа скорости реакции (это следует и из уравнения Аррениуса).
Энергия активации различных реакций различна. Ее величина как раз и показывает влияние природы реагирующих веществ на скорость реакции. Энергия активации молекулярных реакций (H2 + I2 = 2HI и др.) обычно велика. Поэтому скорость таких реакций при низких температурах, как правило, мала и для протекания таких реакций требуется нагревание, иногда очень сильное нагревание. В то же время энергия активации ионных реакций (с участием ионов, например, Ag+ + Cl- ® AgCl) и радикальных реакций (с участием радикалов) обычно невелика и такие реакции протекают очень быстро, то есть скорости этих реакций большие.
1. Понятие о химическом равновесии. Константа химического равновесия.
2. Смещение химического равновесия. Принцип Ле-Шателье.
3. Энергия активации каталитических реакций и сущность действия катализатора.
1. Понятие о химическом равновесии. Константа химического равновесия
Все химические реакции делятся на необратимые и обратимые.
Необратимые химические реакции – это реакции, которые протекают в одном направлении (®) и протекают до конца, то есть до полного израсходования одного из исходных реагирующих веществ.
Пример: Zn + 2HCl ® ZnCl2 + H2
Эта реакция протекает или до полного израсходования цинка (Zn), или до полного израсходования соляной кислоты (HCl).
 Обратимые химические реакции – это реакции, которые одновременно протекают и в прямом, и в обратном направлениях (). Обратимые реакции протекают не до конца и ни одно из реагирующих веществ не расходуется полностью. Обратимая реакция заканчивается установлением химического равновесия.
Обратимые химические реакции – это реакции, которые одновременно протекают и в прямом, и в обратном направлениях (). Обратимые реакции протекают не до конца и ни одно из реагирующих веществ не расходуется полностью. Обратимая реакция заканчивается установлением химического равновесия.
|
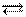 а) N2 + 3H2 2NH3 (синтез аммиака)
а) N2 + 3H2 2NH3 (синтез аммиака)
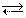 б) CH3COOH H+ + CH3COO- (ионизация кислоты)
б) CH3COOH H+ + CH3COO- (ионизация кислоты)
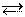 в) KCN + HOH KOH + HCN (гидролиз соли)
в) KCN + HOH KOH + HCN (гидролиз соли)
Признаки необратимости химической реакции:
1) Образование нерастворимого осадка:
AgNO3 + KCl ® AgCl¯ + KNO3;
2) Выделение газа:
Cu + 4HNO3 ® Cu(NO3)2 + 2NO2 + 2H2O;
3) Образование слабого электролита (H2O и др.):
KOH + HCl ® KCl + H2O;
4) Образование прочных комплексов:
AgNO3 + 2NH3 ® [Ag(NH3)2]NO3;
5) Выделение большого количества тепла:
2Mg + O2 ® 2MgO + Q (где Q – очень большое количество тепла).
Рассмотрим гомогенную обратимую реакцию:
 H2(г) + I2(г) 2HI(г)
H2(г) + I2(г) 2HI(г)
На рисунке показано изменение скорости прямой реакции и обратной реакции с течением времени обратимой реакции.
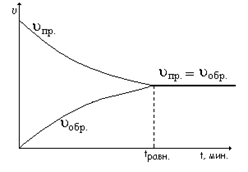
В начальный момент времени при смешении в сосуде исходных веществ (H2 и I2) скорость прямой реакции определяется начальными концентрациями этих веществ и будет большой, а скорость обратной реакции (υобр.) равна нулю, так как концентрация продукта реакции HI в начальный момент времени равна нулю. По мере протекания прямой реакции исходные вещества H2 и I2 расходуются и поэтому их концентрации уменьшаются, в результате этого уменьшается и скорость прямой реакции (υпр.). По мере протекания прямой реакции в сосуде образуется продукт реакции HI, концентрация которого с течением времени увеличивается, поэтому и скорость обратной реакции (υобр.) тоже увеличивается. Когда скорости прямой и обратной реакций становятся равными (в момент времени tравн.), наступает (устанавливается) химическое равновесие между водородом Н2, йодом I2 и йодоводородом HI, то есть число образуемых и распавшихся молекул HI в единицу времени становятся одинаковыми, поэтому концентрации Н2, I2 и HI с течением времени не изменяются, то есть постоянны во времени.
По закону действующих масс, скорости прямой и обратной реакций выражаются следующим образом:
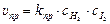
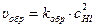
При наступлении химического равновесия υпр. = υобр., откуда получаем
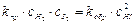 или
или
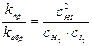
Так как константы скорости kпр и kобр при данной температуре постоянны, то и их отношение kпр/kобр тоже будет постоянной величиной и называется константой химического равновесия данной реакции (обозначается большой буквой К).
Таким образом, 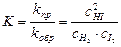
Для гомогенной обратимой реакции в общем виде:
 аА + bВ dD + еЕ
аА + bВ dD + еЕ
константа равновесия будет равна:
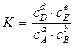 или
или
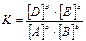 - закон химического равновесия или закон действующих масс для обратимой реакции.
- закон химического равновесия или закон действующих масс для обратимой реакции.
Таким образом, константа химического равновесия обратимой реакции равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ (при этом концентрации веществ берутся в степенях, равных коэффициентам в уравнении обратимой реакции).
Константа равновесия (К) характеризует степень протекания прямой и обратной реакций, а также выход продуктов реакции, и показывает, куда смещено химическое равновесие (влево или вправо). Если К намного больше единицы (например, 103), то равновесие смещено вправо (®) и выход продуктов реакции (веществ D и E) будет большим. И, наоборот, если константа равновесия намного меньше единицы (например, 10-3), то равновесие смещено влево в сторону исходных веществ (¬), поэтому выход продуктов реакции будет мал.
Константа равновесия (К) зависит:
1) от природы реагирующих веществ;
2) от температуры.
Константа равновесия (К) не зависит:
1) от концентрации веществ;
2) от присутствия катализатора.
Константы равновесия можно выражать через концентрации (обозначается Кс), через давления (обозначается Кр) и через активности (обозначается Ка).
Если обратимая реакция протекает в растворе, то константу равновесия этой реакции выражаем через равновесные концентрации веществ, то есть
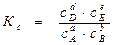 (см. выше)
(см. выше)
Если протекает обратимая реакция:
 аА(г) + bВ(г) dD(г) + еЕ(г),
аА(г) + bВ(г) dD(г) + еЕ(г),
причем все вещества (A, B, D и E) находятся в газообразном состоянии, то константу равновесия можно выразить через парциальные давления газов:
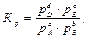
где рD, pE, pA и pB – равновесные парциальные давления газообразных веществ D, E, A и B соответственно.
Для неидеальных газов (когда парциальные давления газов велики) и растворов высоких концентраций (когда концентрации ²с² веществ большие) константу равновесия обратимых реакций выражают через активные концентрации веществ:
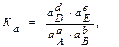
где а – активность или активная концентрация вещества, которая равна:
а = f×c,
где с – истинная концентрация вещества,
f – коэффициент активности.
|
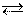 СО2(г) + С(тв) 2СО(г),
СО2(г) + С(тв) 2СО(г),
то константа равновесия будет в этом случае равна:
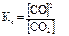
Концентрация твердого углерода С(тв) будет практически постоянной величиной и поэтому не входит в выражение константы равновесия.
Примеры:
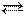 3H2(г) + N2(г) 2NH3(г)
3H2(г) + N2(г) 2NH3(г) 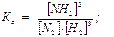
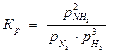
 2SO2(г) + O2(г) 2SO3(г)
2SO2(г) + O2(г) 2SO3(г) 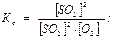
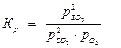
 Fe2O3(тв) + 3CO(г) 3CO2(г) + 2Fe(тв)
Fe2O3(тв) + 3CO(г) 3CO2(г) + 2Fe(тв) 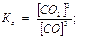
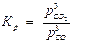
По численному значению константы равновесия реакции можно сказать, куда сдвинуто равновесие обратимой реакции, то есть указать преобладающее (преимущественное) направление реакции (в прямом или обратном направлениях).
О направлении реакции можно сказать и по изменению энергии Гиббса DG°. Поэтому DG° и константа равновесия связаны между собой соотношением:
DG° = -RTlnKр,
где DG° - стандартное изменение энергии Гиббса реакции;
Т – абсолютная температура в градусах Кельвина;
R – газовая постоянная (8,314 Дж/моль×К).
Из уравнения следует, что если DG<0 (то есть имеет отрицательное значение), то Кр>1 и это означает, что реакция протекает преимущественно в прямом направлении (®). Если же DG>0, то Кр<1 и в этом случае реакция преимущественно протекает в обратном направлении (¬).
2. Смещение химического равновесия. Принцип Ле-Шателье
Состояние химического равновесия при данных неизменных внешних условиях сохраняется длительное время. При изменении внешних условий (изменение температуры, давления или концентрации реагирующих веществ) состояние химического равновесия нарушается и происходит смещение химического равновесия или вправо (®), то есть в сторону прямой реакции; или влево (¬), то есть в сторону исходных веществ.
Смещение химического равновесия при изменении внешних условий подчиняется принципу Ле-Шателье, который гласит:
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 900; Нарушение авторских прав?; Мы поможем в написании вашей работы!