
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Системы. Растворы
|
|
|
|
Вещества. Многокомпонентные
Лекция 13. Агрегатные состояния
1. Агрегатные состояния вещества.
2. Многокомпонентные системы.
3. Растворы.
1. Агрегатные состояния вещества
Многие вещества могут, в зависимости от внешних условий (температура, давление), находиться в трех агрегатных состояниях – твердом, жидком и газообразном. Простейшее определение: газы не имеют постоянных объема и формы при постоянной температуре; жидкости имеют постоянный объем, но форма зависит от сосуда; твердые вещества имеют постоянную форму и объем. Наиболее проста теория (и математическое описание) газового состояния. При "нормальных условиях" (0оС или 273,15 К и 1 атм. или 101325 Па) большинство газов вполне удовлетворительно описываются уравнением состояния идеального газа (уравнение Клапейрона-Менделе-ева): pv = nRT. Идеальный газ состоит из частиц (молекул), представляющих собой абсолютно твердые упругие шарики бесконечно малого размера, взаимодействием между которыми (кроме редких упругих столкновений) можно пренебречь. Для многих приблизительных расчетов и решения учебных задач используется следствие из закона Авогадро – при н.у. 1 моль газа (6,022.1023 молекул) занимает объем, равный 22, 4 л.
Реальные мольные объемы некоторых газов при н.у.:
Водород 22,428 л, Гелий 22,424 л, Аммиак 22,400 л, Азот 22,408 л, Кислород 22,392 л, Оксид углерода (IV) 22,261 л, Хлороводород 22,253 л.
Для реальных газов используют уравнения состояния с поправками, учитывающими собственный размер молекул и взаимодействие между ними. Во многих случаях достаточно приближенного уравнения Ван-дер-Ваальса:
(p +a/V2)(V - b) = RT
где, a/V2 – поправка, учитывающая взаимное притяжение молекул ("внутреннее давление");
b – поправка, учитывающая собственный объем молекул и их взаимное отталкивание.
Теория жидкостей разработана гораздо хуже, чем газов, поскольку свойства жидкостей зависят от геометрии и полярности взаимно близко расположенных молекул. Кроме того, отсутствие определенной структуры жидкостей затрудняет их формализованное описание – в большинстве учебников жидкостям уделено гораздо меньше места, чем газам и твердым кристаллическим веществам. Между жидкостями и газами нет резкой границы – она полностью исчезает в критических точках. Для каждого газа известна температура, выше которой он не может быть жидким ни при каком давлении; при этой критической температуре исчезает граница (мениск) между жидкостью и ее насыщенным паром. Существование критической температуры ("температуры абсолютного кипения") установил Д.И.Менделе-ев в 1860 г.
Твердые кристаллические вещества обладают упорядоченной структурой с повторяющимися элементами, что позволяет исследовать их методом дифракции рентгеновских лучей (метод рентгеноструктурного анализа, используется с 1912 г.). Они достаточно подробно описаны в рекомендованных учебниках.
Стеклообразное состояние – твердое аморфное состояние вещества, которое получается в результате глубокого переохлаждения жидкости. Это состояние неравновесно, однако стекла могут существовать длительное время. Размягчение стекла происходит в некотором диапазоне температур – интервале стеклования, границы которого зависят от скорости охлаждения. С увеличением скорости охлаждения жидкости или пара возрастает вероятность получения данного вещества в стеклообразном состоянии.
В конце 60-х годов XX века получены аморфные металлы (металлические стекла) – для этого потребовалось охлаждать расплавленный металл со скоростью 106 - 108 град/с. Большинство аморфных металлов и сплавов кристаллизуются при нагреве свыше 300оС. Одно из важнейших применений – микроэлектроника (диффузионные барьеры на границе металл-полупроводник) и магнитные накопители (головки ЖМД). Последнее – благодаря уникальной магнитомягкости (магнитная анизотропия меньше на два порядка, чем в обычных сплавах).
Жидкокристаллическое состояние – промежуточное между кристаллическим и жидкостью. Жидкие кристаллы обладают одновременно текучестью и анизотропией (оптической, электрической, магнитной). Иногда это состояние называют мезоморфным (мезофазой) – из-за отсутствия дальнего порядка. Верхний предел существования – температура просветления (изотропная жидкость). Термотропные (мезогенные) ЖК существуют выше определенной температуры. Типичные – цианобифенилы.
Лиотропные – при растворении, например, водные растворы мыл, полипептидов, липидов, ДНК...

Рисунок 15. Структура смектических (а и б) и нематических (в) жидких кристаллов.
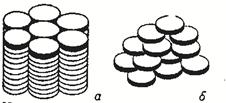
Рисунок 16. Структура дискотических жидких кристаллов: а – колончатая фаза; б – нематическая фаза.

Рисунок 17. Структура холестерических жидких кристаллов.
Смектические ЖК расположены слоями, нематические сохраняют только ориентацию при беспорядочном расположении центров тяжести молекул. Холестерические ЖК образуют слои, с поворотом слоев (ориентаций молекул) на определенный угол друг относительно друга.
Жидкие кристаллы открыты в 1888 г. Ф.Рейнитцером и О.Леманом.
Студни – системы полимер-растворитель, характеризующиеся большими обратимыми деформациями при практически полном отсутствии вязкого течения. Иногда используют термин " гели ", который в коллоидной химии обозначает скоагулированные золи. Наиболее важны студни на основе сетчатых полимеров с разной степенью поперечной сшитости.
При изменении температуры и давления возможен синерезис – отделение части жидкости.
Студни на основе сополимеров акриловой кислоты и акриламида используют для создания мембран с регулируемой проницаемостью, депо для лекарств в организме, в качестве сорбентов и как модели в биологических исследованиях.
2. Многокомпонентные системы
Фаза – совокупность всех гомогенных частей системы, одинаковых по составу и по всем физическим и химическим свойствам (не зависящим от количества вещества) и отграниченных от других частей системы поверхностью раздела. Внутри одной фазы свойства могут изменяться непрерывно, но на поверхности раздела между фазами свойства меняются скачком. Пример двухфазной системы – поверхность реки в ледоход.
Компонентами называют вещества, минимально необходимые для составления данной системы (минимум один). Число компонентов в системе равно числу веществ в ней присутствующих, минус число связывающих эти вещества независимых уравнений.
Компонентом называют вещество, которое может быть выделено из данной системы и количество которого можно менять (хотя бы в некоторых пределах) независимо от других.
Дисперсные системы – гетерогенные системы из двух или большего числа фаз с сильно развитой поверхностью раздела между ними. Одна из фаз образует непрерывную дисперсионную среду, в которой распределена дисперсная фаза в виде мелких кристаллов, твердых аморфных частиц, капель или пузырьков.
Грубодисперсные системы имеют размеры частиц выше 1 мкм, (удельная поверхность не более 1 м2 /г), тонко(высоко)дисперсные или коллоидные системы содержат частицы от 1 нм до 1 мкм (удельная поверхность – сотни м2 /г). По агрегатному состоянию делят на:
газодисперсионные – аэрозоли (дымы, пыли, туманы), порошки, волокнистые материалы;
жидкодисперсионные с твердой дисперсной фазой – грубодисперс-ные суспензии и пасты, высокодисперсные золи и гели;
жидкодисперсионные с жидкой дисперсной фазой – грубодисперс-ные эмульсии, высокодисперсные эмульсии и латексы;
жидкодисперсионные с газовой дисперсной фазой – грубодисперс-ные газовые эмульсии и пены;
твердодисперсионные – например, рубиновые стекла, минералы типа опала, микропористые материалы.
Золи (нем. ед.ч. Sol) (лиозоли, коллоидные растворы) – высокодисперсные коллоидные системы с жидкой дисперсионной средой. Частицы дисперсной фазы золя вместе с окружающей их сольватной оболочкой из молекул (ионов) дисперсионной среды называют мицеллами. Размер частиц лиозоля в пределах 10-7 – 10-5 см. Мицеллы лиофильных золей состоят из дифильных (например, состоящих из гидрофильной и гидрофобной части) молекул, которые находятся в термодинамическом равновесии с неассоциированными молекулами. Пример – мыло в воде. Лиофобные золи неравновесны и требуют стабилизации. Пример мицеллы лиофобного золя бромида серебра: {m[AgBr]nBr-(n-x)K+}xK+
Еще версия терминологии:
Золь – коллоидно-дисперсная система с изолированными друг от друга, а гель – с соприкасающимися (агрессивными) коллоидными частицами; суспензия – грубодисперсная система с относительно малой, а паста – большой концентрацией дисперсной фазы.
3. Растворы
Раствор – это гомогенная система, состоящая из двух и более компонентов и продуктов их взаимодействия. Например, водный раствор KCl. Здесь 2 компонента: вода и хлорид калия.
Растворы могут находиться в трех агрегатных состояниях:
1) твердые растворы или сплавы – например, сплав серебра и золота;
2) газообразные растворы или смесь газов – например, смесь азота и кислорода;
3) жидкие растворы, например, водный раствор сахара, кровь, моча, желудочный сок.
Раствор состоит из растворителя и растворенного вещества. Если оба компонента раствора находятся в одинаковом агрегатном состоянии (например, смешали 20 г жидкого этанола и 50 г жидкого метанола), то растворителем будет тот компонент, масса которого больше (в нашем примере – метанол). Если же смешиваются компоненты в разных агрегатных состояниях (например, жидкая вода и твердый NaCl), то растворителем будет тот компонент, который находится в том же агрегатном состоянии, что и полученный раствор (то есть вода).
Среди многих растворителей особое место занимает вода – это универсальный растворитель, который растворяет многие вещества. Вода – самый распространенный растворитель в промышленности, сельском хозяйстве, быту, медицине и фармации, при проведении химических опытов. Многие биологические жидкости (кровь, моча, желудочный сок и т.д.) – это водные растворы, содержащие все необходимое для жизнедеятельности живых организмов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 678; Нарушение авторских прав?; Мы поможем в написании вашей работы!