
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексні сполуки
|
|
|
|
· СУЧАСНІ УЯВЛЕННЯ ПРО БУДОВУ КОМПЛЕКСНИХ СПОЛУК.
Вже у першій половині XIX ст. вчені помітили, що деякі сполуки, в яких атоми начебто вичерпали свої валентні можливості, здатні до подальшого сполучення між собою. Так, у разі додавання аміаку до купрум (ІІ) сульфату утворюється складніша сполука СuSО4×4NН3. Реакція супроводжується зміною забарвлення реакційної суміші від синього до значно інтенсивнішого синьо-фіолетового. Прикладів сполучення «простих», або «звичайних», речовин з утворенням складніших сполук було вивчено дуже багато, зокрема КСl×СuСl, 4КСN×Fе(CN)2, 2КІ×НgІ2, 3NаF×АlF3, 2КF×SіF4, ZnSО4×4NН3, 3КОН×А1(ОН)3. Оскільки такі сполуки є складними, їх назвали комплексними. Однак як саме сполучені складові цих сполук (у наведених вище формулах процес сполучення позначено крапкою) ще тривалий час залишалося нез'ясованим. Робилась спроба пояснити будову цих сполук, за аналогією з органічними сполуками, утворенням ланцюгів атомів (наприклад, ланцюг атомів Нітрогену в сполуці СuSО4×4NН3), але ланцюгова теорія була неспроможна пояснити властивості комплексних сполук.
Лише у 1893 р. видатний швейцарський учений А. Вернер запропонував координаційну теорію, згідно з якою у таких сполуках існує атом-комплексоутворювач, який координує навколо себе більше число іонів протилежного знака чи молекул, ніж дозволяє його звичайна валентність (ступінь окиснення). Наприклад, згідно з теорією Вернера в сполуці СuSО4×4NН3 усі чотири молекули аміаку NН3 приєднані до атома Купруму.
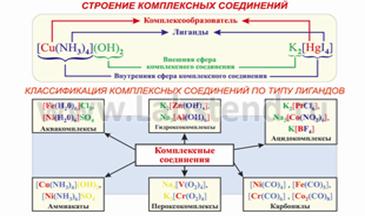
Головною ознакою комплексних сполук є координація, тобто приєднання до центрального атома більшого числа інших частинок, ніж це випливає з його звичайної валентності, тому комплексні сполуки називають також координаційними.
ОСНОВНІ ПОЛОЖЕННЯ КООРДИНАЦІЙНОЇ ТЕОРІЇ
Комплексоутворювачем вважають центральний атом чи іон, до якого приєднуються нейтральні молекули або аніони. Оскільки комплексні сполуки утворюються за донорно-акцепторним механізмом, то комплексоутворювачі здебільшого мають бути акцепторами електронів і мати вільні електронні орбіталі. Зазвичай роль комплексоутворювачів виконують малі за розміром і атоми металів (значно рідше - неметалів) або катіони металів, на поверхні яких зосереджується надлишковий позитивний заряд. Найчастіше комплексо-утворювачами є катіони d-металів: Сu2+, Со2+, Со3+, Сr3+ і багато інших.
Лігандами (приєднаними частинками) називають молекули або іони, які координуються навколо комплексоутворювача. Разом з останнім вони утворюють координаційну сферу і є донорами електронних пар. Здебільшого роль лігандів виконують нейтральні молекули, до складу яких входять найбільш електронегативні атоми Оксигену (вода, спирти, кислоти, ефіри тощо), Нітрогену (аміак, аміни) або аніони (F-, Сl-, Вг-, NCS-, СО32-, C2O42- тощо). Досить численнми є також ліганди, що містять у своєму складі атоми інших неметалівю
Координаційне число визначається числом місць у просторі, які може надавати комплексоутворювач для приєднання лігандів. Іншими словами, координаційне число відповідає числу хімічних зв'язків між комплексоутворювачем і лігандами. Воно залежить як від природи комплексоутворювача, так і від характеру лігандів. Так, А13+ з меншим за розміром іоном F- утворює комплекс [А1F6]3-, координаційне число якого дорівнює 6, а з більшим іоном Сl- - комплекс [А1С14]-, координаційне число якого дорівнює 4. Для більшості комплексних сполук (майже 95 %) координаційне число дорівнює 4 або 6. Часто координаційне число для іонів відповідає подвоєному ступеню окиснення комплексоутворювача:

Внутрішню координаційну сферу комплексної сполуки складають комплексоутворювач разом з лігандами, які приєдналися відповідно до координаційного числа комплексоутворювача. Внутрішню координаційну сферу позначають у квадратних дужках. Вона може бути нейтральною або мати певний позитивний чи негативний заряд. Заряд внутрішньої координаційної сфери визначається сумою зарядів комплексоутворювача й усіх лігандів:
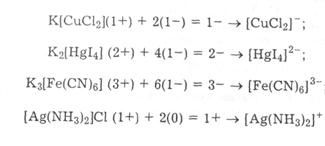
Заряд внутрішньої координаційної сфери дорівнює сумарному заряду всіх іонів зовнішньої сфери, взятому з протилежним знаком. Коли ліганди є нейтральними молекулами, заряд внутрішньої координаційної сфери збігається із зарядом комплексоутворювача. Якщо внутрішня координаційна сфера має негативний заряд, комплекс виявляє аніонний характер, якщо позитивний — катіонний, якщо нейтральний — комплекс є неелектролітом.
Протиіони — це іони зовнішньої сфери (катіони або аніони), які компенсують заряд внутрішньої координаційної сфери, щоб речовина загалом була електронейтральною. У наведених вище прикладах протиіонами є катіони К+ та аніони Сl-. Протиіони не входять до складу внутрішньої координаційної сфери, їх можна легко замінити на інші подібні іони. Якщо замінити зовнішні іони, властивості речовини змінюються мало, якщо ж змінити один з компонентів у внутрішній координаційній сфері комплексу, то утвориться нова сполука із зовсім іншими властивостями.
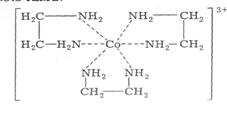
Дентатність ліганду визначається числом атомів, які одночасно можуть утворювати зв'язки з комплексоутворювачем. Наприклад, молекула NН3 займає лише одне координаційне місце, і тому цей ліганд є монодентатним. Етилендіамін NН2С2Н4NН2 координується двома атомами Нітрогену і тому є бі-, або дводентатним. Діетилентриамін NН2С2Н4NНС2Н4NH2 може займати три ко-ординаційні місця і є тридентатним. Іон Со3+ з цими лігандами утворює комплексні сполуки такого складу: [Со(NН3)6]Сl3; Со(NН2С2Н4NH2)3]С13; [Со(NH2С2Н4NНС2Н4NH2)2]С13, тобто число приєднаних лігандів дорівнює координаційному числу, поділеному на дентатність ліганду. Ось чому координаційне число не завжди збігається з числом приєднаних лігандів.
Ліганди типу етилендіаміну утворюють так звані хелатні, або клішнеподібні, комплекси, в яких ліганди разом з комплексоутворювачем будують стійкі п'ятичленні цикли (подібно до шестичленних в органічних сполуках). Такі ліганди називають хелатоутворюючими
Внутрішню координаційну сферу можуть утворювати як однакові, так і різні ліганди. Якщо до складу внутрішньої координаційної сфери входять різні ліганди, комплекси називають різнолігандними, наприклад [Рt(NH3)2]Cl2, [Со(NH)5Вr]SО4.
Деякі ліганди можуть координуватися різними способами, такі ліганди налипають амбідентатними. Наприклад, іон NCS- може координуватися одним з двох кінцевих атомів — атомом нітрогену або сульфуру.
Залежно під швидкості заміщення одних лігандів на інші комплексні сполуки поділяють на інертні (повільне заміщення) та лабільні (швидке заміщення). Багато інертних комплексних сполук утворюють іони Со3+, Рt2+, Рt4+, Сr3+ та деякі інші комплексоутворювачі.
Комплексним сполукам, як і органічним речовинам властиве явище ізомерії.
Деякі комплексні сполуки існують тільки у твердому стані, а у водних розчинах повністю розщеплюються на іони, тому їх відносять до подвійних солей, наприклад галуни К[А1(SО4)2]×12Н2О; К[Сr(SО4)2]×12Н2О.
НОМЕНКЛАТУРА КОМПЛЕКСНИХ СПОЛУК
Назву комплексній сполуці дають за переліченими нижче правилами.
1.У комплексних сполуках першим називають катіон, а потім аніон.
2.У комплексних сполуках ліганди називають перед комплексоутворювачем. Перелік лігандів ведуть в абетковому порядку.
[Pt(NH3)2ClBr] – діамінбромохлороплатина (ІІ)
[Co(NH3)4(H2O)Cl]Cl2 – акватетраамінхлорокобальт (ІІІ) хлорид
Назви деяких найпоширеніших лігандів

NO2- - нітро; CO – карбоніл; CNS- - тіоціано.
3.До назв аніонних лігандів додають закінчення –о, а нейтральні ліганди називають так само, як і молекули.
4.Число лігандів кожного виду (якщо їх число перевищує одиницю) вказують грецькими префіксами: ди- (2), три- (3), тетра- (4), пента- (5), гекса- (6).
Якщо ж такий самий префікс є у назві ліганду (діетилентриамін, етилендіамін), то назви лігандів беруть у дужки ф перед ними ставлять префікси іншого типу: біс- (2), тріс- (3), тетракіс- (4), пентакіс- (5), гексакіс- (6). Наприклад: [Cr(En)3]Cl3 – тріс(етилендіамін)хром (ІІІ) хлорид
5.У назву комплексного аніону має входити суфікс –ат. Комплексоутворювач, що входить до складу катіону чи нейтральної молекули не має закінчення.
6.Ступінь окиснення комплексоутворювача вказують у дужках римською цифрою відразу за назвою комплексоутворювача.
K[CuCl2] – калій дихлорокупрат (ІІ), [Cr(H2O)3NH3Br2](NO3)2 – триаквааміндибромохром (ІІІ) нітрат.
ПРОСТОРОВА БУДОВА КОМПЛЕКСНИХ СПОЛУК
Залежно від координаційного числа комплексні сполуки мають різну просторову будову. Якщо координаційне число дорівнює 2, то частинки внутрішньої координаційної сфери розміщені лінійно:
K[Cl – Cu – Cl]
Якщо координаційне число дорівнює 4, то внутрішня координаційна сфера може мати тетраедричну (здебільшого) або квадратно-площинну будову з комплексоутворювачем, розміщеним у центрі:
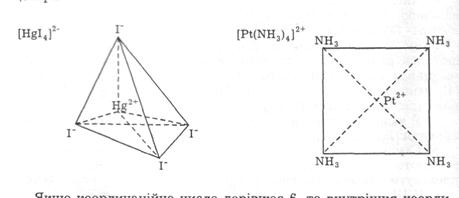
Якщо координаційне число дорівнює 6, то внутрішня координаційна сфера має октаедричну або біпірамідальну просторову будову з центральним положенням комплексоутворювача:
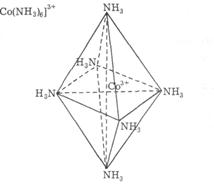
ІЗОМЕРІЯ КОМПЛЕКСНИХ СПОЛУК
Комплексним сполукам властива ізомерія. Найпоширеніші види ізомерії коротко схарактеризовано нижче
А. Просторова ізомерія:
- Геометрична (цис- і транс-ізомерія);
- Оптична
Б. Структурна ізомерія:
- Сольватна (гідратна)
- Іонізаційна
- Координаційна
- Ізомерія зв’язку
Гідратна ізомерія полягає в різному розміщенні молекул води у внутрішній і зовнішній координаційних сферах. Наприклад, формулі СrСl3×6Н2О відповідають три комплексні сполуки: [Сr(Н2О)6]С13 — фіолетового кольору, [Сr(Н2О)5С1]С12×Н2О — світло-зеленого і [Сr(Н2О)4С12]С1×2Н2О — темно-зеленого кольору.
Іонізаційна ізомерія полягає в різному розміщенні іонів у внутрішній і зовнішній сферах. Наприклад, формулі Со(NН3)3Вr×SO4 відповідають дві комплексні сполуки: [Со(NН3)5Вr]SО4, з розчину якої легко осаджується ВаSО4 і важко — АgВr, і [Со(NH3)5SО4]Вr, з розчину якої, навпаки, легко oсаджується АgВr і важко — ВаSО4.
Координаційна ізомерія, за якої комплексоутворювачі немовби обмінюються лігандами:
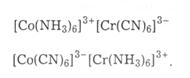
Ізомерія зв'язку. Деякі ліганди, наприклад іони СN-, NCS-, NO2-, мають по два донорні атоми і можуть координуватися різними способами, тобто є амбідентатними лігандами. Так, іон NO2- може координуватись як атомом Нітрогену, так і атомом Оксигену. У першому випадку утворюються нітрокомплекси [Co(NH3)5NO2]Br2, у другому — нітритокомплекс [Co(NH3)5ONO]Br2. Стійкішим у цьому є нітрокомплекс, нітритокомплекс мимовільно перетворюється на нітрокомплекс.
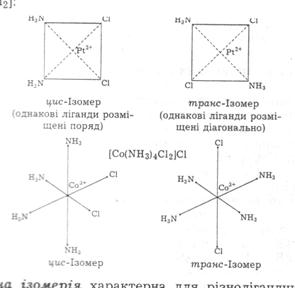
Геометрична ізомерія полягає в різному просторовому положенні лігандів відносно комплексоутворювача. Вона властива різнолігандним комплексним сполукам з квадратно-площинною або октаедричною (чи біпірамідальною) структурою, наприклад [Р1(NН3)2С12]:
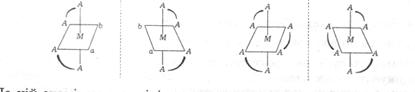
Оптичнаізомерія характерна для різнолігандних або хелатних комплексних сполук, у цьому разі один ізомер є дзеркальним відбитком іншого. Оптичні ізомери утворюються одночасно в однакових кількостях і складають рацемічну суміш. Прикладом можуть бути ізомери комплексних сполук загальної формули цис-[М(АА)2аb]п+ та [М(АА)3]п+:
ХІМІЧНІ ВЛАСТИВОСТІ КОМПЛЕКСНИХ СПОЛУК
Хімічні властивості комплексних сполук залежать від природи комплексоутворювача, лігандів і дещо меншою мірою — від природи іонів, розміщених у зовнішній координаційній сфері
Як і для інших речовин, для комплексних сполук характерні найрізноманітніші перетворення, однак найтиповішими є такі групи реакцій:
1) реакції обміну іонів зовнішньої сфери;
2) реакції обміну, приєднання або відщеплення лігандів;
3) реакції відновлення або окиснення комплексоутворювача;
4) реакції перетворення координованих молекул або іонів;
5) ізомеризація комплексних сполук.
Розглянемо приклади перелічених реакцій та їх застосування в хімії.
Реакції обміну іонів зовнішньої сфери застосовують як під час добування комплексних сполук, так і в хімічному аналізі. У разі нагрівання водного розчину [Со(NН3)5С1]Сl2 утворюється суміш сполук, у тому числі й [Со(NН3)5Н2О]С13. Виділити останню сполуку із суміші в чистому вигляді важко, тому суміш піддають дії солі щавлевої кислоти (NН4)2С2О4, внаслідок чого іони Cl- зовнішньої сфери обмінюються на іони C2O42-
2[Со(NН3)5Н2O]С13 + 3(NН4)2С2O4 = [Со(NH3)5Н2О]2(С2О4)3¯ + 6NH4Cl.
Малорозчинна комплексна сполука, що утворилася, легко відокремлюється від домішок. Реакціями обміну із сильними кислотами добувають інші аквапентамінові комплексні сполуки Со(NН3)5Н2О]Х3 (де X — однозарядні аніони), наприклад:
[Со NH3)5Н2О]2(С2О4)3 + 6НС1 = 2[Со(NН3)5Н2O]С13 + ЗН2С2О4.
Для виявлення в розчинах іонів К+ використовують розчин комплексної сполуки Nа3[Со(NО2)6], яка вступає в реакцію обміну із солями калію з утворенням осаду жовтого кольору:
2КС1 + Nа3[Со(NO2)6] = К2Nа[Со(NО2)6]¯ + 2NаС1.
Комплексні сполуки К3[Fе(СN)6] і К4[Fе(СN)6] легко обмінюють іони К+ зовнішньої сфери на іони d-елементів, внаслідок чого утворюються малорозчинні сполуки. Такі реакції використовують, зокрема, для виявлення в розчинах іонів Fe2+ і Fe3+
FеС12 + К3[Fе(СN)6] = КFе[Fе(СN)6]¯ + 2КС1;
FеС13 + К4[Fе(СN)6] = КFе[Fе(СN)6]¯ + 3КС1.
Реакції обміну лігандів. Реакції добування комплексних сполук у розчинах із звичайних солей найчастіше є реакціями обміну координованих молекул розчинника на інші ліганди.
Розглянемо реакцію добування аміакату нікелю під дією аміаку на водний розчин сульфату нікелю NiSO4. У разі розчинення NіSO4 у воді іон Ni2+ координує молекули води й утворює аквакомплекс [Ni(Н2О)6]2+. Під дією аміаку молекули води у внутрішній координаційній сфері обмінюються на молекули аміаку:
[Ni(Н2О)6]SО4 + 6NH3 = [Ni(NH3)6]SО4 + 6Н2О.
Ця реакція відбувається в кілька стадій, послідовно утворюються комплексні сполуки [Ni(NH3)(Н2О)5]SО4, [Ni(NН3)2(Н2О)4]SО4 і т. д. до [Ni(NH3)6]SO4.
Прикладом такої реакції може бути взаємодія [Pt(NH3)2Cl2] з хлором, внаслідок якої одночасно з процесом приєднання лігандів Cl- змінюється ступінь окиснення платини від +2 до +4:
[Pt(NH3)2Cl2] + Cl2 = [Pt(NH3)2Cl4]
Зворотна реакція – відновлення комплексних сполук платини (IV) – супроводжується відщепленням лігандів:
K2[PtCl6] + K2C2O4 = K2[PtCl4] + 2KCl + 2CO2.
Реакції відновлення тв окиснення комплексоутворювача можуть відбуватися і без зміни оточення лігандів. Такою реакцією є добування калій гексаціаноферрата (ІІІ):
2K4[Fe(CN)6] + Cl2 = 2K3[Fe(CN)6] + 2KCl
aбо багатьох комплексних сполук кобальту (ІІІ):
4[Co(NH3)6]2+ + O2 + 2H2O =4[Co(NH3)6]3+ + 4OH-
Цю реакцію проводять у розчині, який містить іони NH4+ для зв’язування іонів ОН-.
БІОЛОГІЧНО ВАЖЛИВІ ТИПИ КООРДИНАЦІЙНИХ СПОЛУК.
МЕТАЛОЛІГАНДНИЙ ГОМЕОСТАЗ. ЗАСТОСУВАННЯ КОМПЛЕКСНИХ СПОЛУК У МЕДИЦИНІ.
Використання комплексних сполук у медицині.
Комплексні сполуки відіграють велику роль у життєдіяльності організмів; наприклад, гемоглобін, хлорофіл є комплексними сполуками.
Комплексні (координаційні) сполуки надзвичайно широко поширені в живій і неживій природі, застосовуються в промисловості, сільському господарстві, науці, медицині.
Так, хлорофіл - це комплексне з'єднання магнію з порфірітами, гемоглобін містить комплекс заліза (II) з порфірітовимі циклами. Численні мінерали, як правило, представляють собою координаційні сполуки металів.
Значна кількість лікарських препаратів містить комплекси металів як фармакологічно активних речовин, наприклад інсулін (комплекс цинку), вітамін B12 (комплекс кобальту), платінол (комплекс платини) і т.д.
Сполуки Ауруму з прадавніх часів використовували для лікування прокази. Нині комплекси цього металу застосовують для лікування ревматоїдних артритів, наприклад хризолан Na3[Au(S2O3)2] та деякі комплекси Ауруму з органічними лігандами (кризанол, санакризин). Ці сполуки інкубують гідролітичні ферменти, що пошкоджують суглоби. Деяку біологічно активні препарати Ауруму використовують для лікування туберкульозу.
Комплексні сполуки Цинку широко використовують у дерматології як протимікробні засоби, а карбоніли Феруму, зокрема ферроцерон (натрієва сіль карбоксибензоїл-ферроцену) належить до нових медичних препаратів для лікування ферумдефіцитних (залізодефіцитних) анемій.
Серед комплексних сполук Платини важливе значення має електронейтральний комплекс цис-дихлордіамінплатинаPt(NH3)2Cl2. У 1969 році було виявлено протипухлинову активність цієї сполуки і доведено, що в ураженій злоякісною пухлиною клітині цис- дихлордіамінплатина зв’язується з молекулами ДНК, інгібуючи їх синтез. Цікаво, що транс-ізомер цієї сполуки не виявляє жодної біологічної активності.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 20785; Нарушение авторских прав?; Мы поможем в написании вашей работы!