
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стехиометрия горения
|
|
|
|
Рассмотрим горючую систему, состоящую из смеси горючего и окислителя в газообразном состоянии.
При химическом превращении происходит разрыв молекулярных связей, удерживающих атомы в одних молекулах, и образование новых связей в молекулах других, возникающих в ходе реакции веществ.
Число атомов при реакции не изменяется, происходит лишь их перегруппировка, которая связана с поглощением или выделением энергии. Сохранение атомного состава можно записать в виде равенства числа атомов для каждого химического элемента
 (3.1)
(3.1)
где mik – число атомов k-го химического элемента в i-ой молекуле, Ni – число i-х молекул в горючей системе, Bk – полное число атомов данного химического элемента в смеси.
Количество уравнений вида (3.1) соответствует количеству химических элементов K, присутствующих в системе.
Равенство (3.1) выполняется при любом состоянии горючей системы, именно
а) до начала горения, когда энергия накоплена в химических связях;
б) при завершении горения, когда высвободившаяся энергия увеличивает температуру в системе до максимального значения;
в) в любой промежуточный момент реагирования.
Предположим, что в системе протекает только одна реакция. Если записать равенства (3.1) для начального и конечного состояния системы, то можно стехиометрическое уравнение реакции горения в общем виде
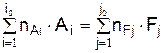
где Ai – химический символ i-го исходного вещества; Fj – химический символ j-го конечного вещества; nAi, nFj – стехиометрические коэффициенты; i0 – количество исходных веществ; j0 – количество конечных веществ.
Если исходные вещества взяты в таком соотношении, что химическое превращение полностью переводит их в продукты реакции, то горючая смесь называется стехиометрической. Если в исходной смеси одно из веществ содержится в количестве меньшем, чем требуется по стехиометрическому уравнению, то говорят, что оно находится в недостатке.
Для определения количества окислителя, расходуемого на горение, и вычисления количественного состава продуктов горения введём понятие горючей системы стехиометрического состава.
Горючей системой стехиометрического состава называется система с минимально необходимым для полного горения соотношением между количествами окислителя и горючего, которое приводит к образованию продуктов, неспособных к последующему горению. В стехиометрической системе не содержится в избытке ни горючее, ни окислитель. При избытке горючего горючая смесь в системе становится богатой, а при избытке окислителя – бедной.
Стехиометрическое уравнение горения, выражающее собой уравнение материального баланса, в простейшем случае имеет вид
 ,
,
где А1 – химический символ горючего вещества; А2 - химический символ окислителя; F – химический символ продуктов горения; nA1, nА2, nF – стехиометрические коэффициенты уравнения реакции горения, представляющие собой количества реагирующих и образующихся веществ, измеренные в молях.
Величину, кмоль/кмоль,

называют удельным стехиометрическим коэффициентом реакции горения.
Для водородо-кислородной смеси стехиометрическое уравнение горения имеет вид:
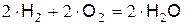
где 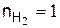 кмоль,
кмоль,  кмоль,
кмоль,  кмоль.
кмоль.
Из стехиометрических соотношений этого уравнения следует, что удельный стехиометрический коэффициент реакции горения метана, кмоль/кмоль,
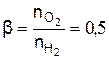 .
.
Для горючей молекулы сложного состава
 ,
,
где mС, mS, mH, mP, mO – соответственно число атомов углерода, серы, водорода, фосфора и кислорода в молекуле горючего вещества; mХ – число атомов галогенов в молекуле горючего вещества.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2974; Нарушение авторских прав?; Мы поможем в написании вашей работы!