
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Причины устойчивости литиевого электрода
|
|
|
|
Литий – высокоактивный щелочной металл. Это свойство лития особенно ярко проявляется при попытке создать его чистую поверхность. Даже следовые количества вещества извлекаются им из окружающей среды. Даже в условиях сверхвысокого вакуума литиевая поверхность, «очищенная» ионной бомбардировкой, за считанные секунды «вылавливает» молекулы остаточного газа и покрывается тончайшей пленкой из продуктов взаимодействия. Литий энергично взаимодействует не только с водой, но и с азотом (нацело):
6Li + N2 → 2Li3N
С влажными газами реакция идет с образованием LiOH и также нацело.
Более того, термодинамические расчеты показывают принципиальную возможность восстановления литием ВСЕХ мыслимых веществ, которые могли бы использоваться вместо воды в качестве растворителя, даже предельных углеводородов. Например, восстановление ПК протекает по схеме:

Для этой реакции ∆ G = –820 кДж/моль. Восстановление ЭК протекает по схеме:
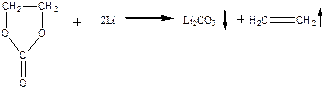
Для этой реакции ∆ G = –484 кДж/моль.
Величины изменения энергии Гиббса ∆ G реакций восстановления растворителей имеют огромные отрицательные значения. В этом отношении эти растворители ничем не отличаются от воды. В то же время сам факт промышленного выпуска литиевых элементов, способных храниться годами, указывает на то, что сохранность литиевого электрода не является проблемой.
В настоящее время твердо установлено, что устойчивость Li в контакте со многими газами и растворителями обеспечивается образованием на поверхности металла защитной пленки из нерастворимых продуктов взаимодействия. В приведенных выше реакциях – это карбонат лития Li2CO3. В различных электролитах могут, кроме того, образовываться Li2O, LiCl, LiF и некоторые другие соли лития. Защитная пленка очень тонкая (несколько нанометров или десятков нанометров) и невооруженным глазом не видна.
Требования к чистоте растворителя и солей для электролита очень высокие. Допустимое содержание примесей составляет тысячные доли процента. Такие же требования к содержанию воды в электролите, которая является здесь очень нежелательной примесью (например, допустимая концентрация воды 30 ррm = 0.003 масс. %). В контакте с такими чистыми электролитами литий может храниться десятилетиями. Для многих типов выпускаемых ЛИТ гарантированный срок хранения составляет 10 или даже 15 лет. Саморазряд при комнатной температуре находится на уровне менее 1% в год. Обязательное требование к ЛИТ – полная герметичность, чтобы не допустить поглощения влаги и других примесей из окружающей среды.
Рассмотрим некоторые электрохимические системы с литиевым анодом, дошедшие до стадии промышленного выпуска.
Система Li│LiBr│SO2
Это – электрохимическая система с жидким катодом-электролитом. Здесь, как и в системе Li│H2O, в одном веществе (жидком SO2) объединены и растворитель, и активное катодное вещество-окислитель. Электрохимическое восстановление растворителя в этом случае протекает на специальном инертном электроде, в качестве которого обычно используется углерод. Диоксид серы SO2 находится в ячейке в жидком состоянии под небольшим давлением (3 атм.) Основная токообразующая реакция следующая:
Li + SO2 → ½ Li2S2O4↓
дитионит лития
Эта реакция протекает совершенно необратимо, для неё НРЦ = 2.95 В, среднее разрядное напряжение в зависимости от скорости разряда и температуры составляет 2.9 – 2.7 В. Разрядные кривые очень плоские, почти идеальные (см. рисунок).
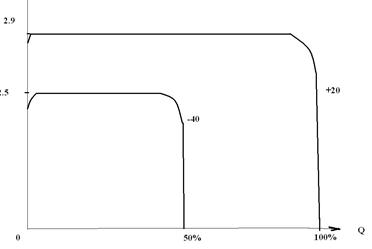
Разрядные характеристики Li│SO2-элемента при различной температуре (схематично).
Достоинства системы Li│SO2:
- Высокие значения удельных параметров (это общее свойство всех ЛИТ): 300 – 350 Вт·ч/кг и 500 – 550 Вт·ч/л.
- Очень широкий температурным интервал работоспособности: от –60°С до +70°С. Li│SO2 элементы способны вполне удовлетворительно работать при температуре ниже –50°С.
- Сохраняемость ХИТ Li│SO2 более 10 лет, в том числе они допускают хранение при температуре до +80°С.
Недостатки системы Li│SO2:
Ø Гальванические элементы Li│SO2 не выдерживают большой плотности разрядного тока (впрочем, как и все ЛИТ, кроме водных). Их обычный режим – умеренный разряд на уровне 0.05С, максимально допускается нагрузка примерно 0.5С.
Ø Работа при повышенном внутреннем давлении потенциально опасна разгерметизацией ХИТ.
Ø Небольшой начальный «провал напряжения».
Система Li│LiAlCl4│SOCl2
Это также система с жидким растворителем-окислителем. Элементы системы Li/ТХ обладают максимальной удельной энергией среди всех разработанных ХИТ длительного действия – до 650 Вт·ч/кг или до 1300 Втч/л. Токобразующая реакция следующая (также совершенно необратимая):
4Li + 2SOCl2 → 4LiCl↓ + S↓ + SO2↑
ЭДС = НРЦ=3.67 В. Рабочее напряжение составляет в зависимости от тока разряда 3.3 – 3.5 В. Разрядная характеристика такая же чрезвычайно стабильная, как и у Li│SO2 элементов. Температурный интервал работоспособности от –70°С до +70°С, ЛИТ выдерживает кратковременное повышение до +100°С. Сохраняемость элементов в залитом состоянии 5 лет и более.
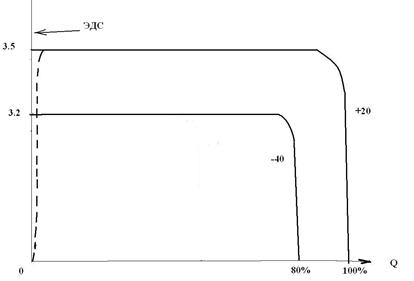
Разрядные характеристики Li│SOCl2-элемента при различной температуре (схематично).
ЛИТ Li│SO2 и особенно Li│SOСl2 обладают наивысшим характеристиками и выпускаются во всех промышленно развитых странах в широких масштабах в самых различных типоразмерах. В России производятся в г. Новочеркасск.
Достоинства и недостатки системы Li│SOСl2 примерно те же, что и системы Li│SO2, но более ярко выражены. Важно отметить следующие проблемы:
- Потенциальная опасность при эксплуатации, возможность взрыва и возгорания; такие ХИТ обязательно снабжаются защитными клапанами, предохранителями, электронной защитой от переразряда. Полностью безопасные ЛИТ с SOСl2 пока не созданы.
- Выраженный начальный «провал напряжения» после длительного хранения (особенно после высокотемпературного хранения).
Причина «провала напряжения» – образование на поверхности лития толстой защитной пленки, обладающей большим сопротивлением, т.к. слагающие ее вещества обладают очень низкой электропроводностью, практически это диэлектрики. После включения тока под его действием толстая пленка разрушается, но этот процесс может длиться несколько минут. В течение периода разрушения пленки элемент оказывается практически неработоспособным, его напряжение может упасть до нуля, как показано на рисунке, где крупно изображен начальный фрагмент разрядной кривой.
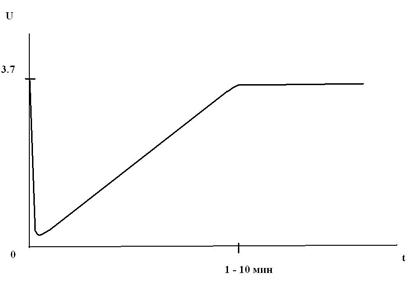
«Провал напряжения» на разрядной кривой Li│SOCl2-элемента (схематично).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 565; Нарушение авторских прав?; Мы поможем в написании вашей работы!