
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция №9
|
|
|
|
Тема: (продолжение) Реальные газы. Уравнение Ван-дер-Вальса и его анализ. Понятие критической температуры в технике для сжижения газов. Жидкие газы, методы их получения и приемы использования. Некоторые свойства жидкостей: диффузия, поверхностное натяжение, капиллярность и испарение. Жидкие кристаллы. Твердые тела.
При повышения давления возрастает плотность газа и потому начинает играть существенную роль собственные объемы молекул и силы взаимодействия между ними.
Уравнение состояния реального газа получено в 1873 году голландским физиком Я. Д. Ван-дер-Ваальсом, который ввел в уравнение Менделеева-Клайперона поправку на размер молекул и учел силы
взаимодействия между ними. Это уравнение носит его имя и имеет вид:
(Р + 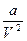 ) (V – b) =
) (V – b) = 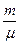 RT,
RT,
где а и b поправки на силы взаимодействия молекул и собственный объем.
Критической называется такая температура, при которой плотность жидкости и ее насыщенного пара становится одинаковой. При температурах же выше критической вещество может существовать только в газообразном состоянии. Газ, температура которого выше критической, не может быть никаким сжатием переведен в жидкое состояние.
Внутренняя энергия реального газа является функцией двух параметров: температуры Т и объема V.
Для киломоля она определился формулой:
Uкм = СvT - 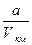 .
.
Из выраженияследует, что внутренняя энергия увеличивается при повышении температуры Т и увеличения объема V.
Если газ будет расширяться или сжиматься без теплообмена с внешней средой и без совершения внешней работы, то согласно первому началу термодинамики его внутренняя энергия должна оставаться постоянной. В этом случае дифференцирование выражения даст:
d Uкм = Сv dT + 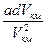 = 0,
= 0,
откуда следует, что dТ и dV км имеют разные знаки. Следовательно, при расширении в таких условиях газ должен всегда охлаждаться, а при сжатии – нагреваться. Понятие критической температуры сыграло большую роль в физике низких температур и технике сжижения газов. Благодаря этому стало очевидным, что любой газ можно превратить в жидкость путем сжатия с предварительным охлаждением до температуры, меньшей критической. В технике для сжижения газов широко применяются машина Линде и детандеры.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 417; Нарушение авторских прав?; Мы поможем в написании вашей работы!