
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второй закон термодинамики. Первый закон термодинамики
|
|
|
|
Первый закон термодинамики
Количество тепла подведенного к телу расходуется на изменение его внутренний энергии и на совершение работы.
Q = ΔU + L
ΔU - внутрения энергия, Дж
L - совершаемая работа, Дж
Если L = 0, то Q = Δu = I
где L – энтальпия, Дж(Дж/Н3);
Согласно второму закону термодинамики теплота не может само произвольно переходить от тела с меньшей температурой, к телу с большей температуре для осуществление этого процесса нужно затратить работу.
dQ = dU + dl
Любой самопроизвольный процесс является необратимым. Это процесс теплообмена.
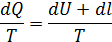
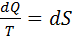 - изменение энтропии, Дж/К;
- изменение энтропии, Дж/К;
Величина энтропии характеризуется направлению протекания термодинамических процессов. Если dS положительно, то в системе происходит поглощение тепла если dS отрицательна, то в системе происходит овход тепла.
Частные термодинамические процессы
Уравнение политропы
pvn = const n = 0 ± ∞
Частные термодинамические процессы
1) n = 0, P = const - изобарный процесс;
2) n = 1, T = const - изотермический процесс;
3) n = ±∞, V = const - изохорный процесс;
4) n = k, S = const - адиабатический процесс;
Графическое изображение частные термодинамические процессы
координатах PV и TS имеет вид;

 P n = T n = k
P n = T n = k
 |  | ||||
 | |||||





n = 1
 n = 0 n = ±∞
n = 0 n = ±∞

 n = 0
n = 0
n = 1
n = ±∞


 v S
v S
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 292; Нарушение авторских прав?; Мы поможем в написании вашей работы!