
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Введение в теорию открытых систем
|
|
|
|
Термодинамика экосистем
Т Е М А 1
Краснодар, 2009
ИЗБРАННЫЕ ЛЕКЦИИ ПО КУРСУ ХИМИЧЕСКОЙ ЭКОЛОГИИ
(УЧЕБНОЕ ПОСОБИЕ)
(Допущено Министерством сельского хозяйства Российской Федерации в качесве учебного пособия для студентов агрономических специальностей сельскохозяйственных вузов)
Составители:проф., д.х.н. В.Н. Заплишный
доцент Н.Я.Губанова
доцент, к.х.н. В.С. Заводнов
Под общей редакцией д.х.н.,проф. С.П.Доценко
Рецензенты:д.б.н., профессор, зав.кафедрой прикладной экологии КубГАУ В.В.Стрельников;
д.б.н.,профессор кафедры генетики, микробиологии и биотехнологии КГУ С.Н.Щеглов.
Рассмотрено и утверждено на заседании кафедры органической и физколлоидной химии Кубанскуого госагроуниверситета (протокол № 8 от 23.06.2009г) и на заседании методического Совета факультета агрохимии, агропочвоведения и защиты растений (протокол №6 от 29.06. 2009г)
В пособии приведены избранные лекции по актуальным темам относительно новой для аграрного профиля вузов дисциплины- химической экологии. Такие важные для студентов аграрных вузов темы, как: термодинамика, супертоксиканты-диоксины, стерины, стероиды, пестициды, боевые отравляющие промышленные вещества, антибиотики рассмотрены с точки зрения характеристики их пространственого строения, экологии и возможности их реального влияния на нарушение экологического равновесия на региональные экосистемы и биоту в целом. Можно также рекомендовать в качестве дополнения и для студентов биологических специальностей других вузов.
Вторую половину XX века по праву считают новой эрой в науке — эрой биологии. Если рассмотреть наихарактерные и универсальные признаки живой природы, то они заключаются, во-первых, в том, что все живое на Земле расходует энергию с достаточно высокой степенью эффективности, а во-вторых - для живого организма характерны все признаки самоорганизующейся системы.
Древние философы считали, что вещь не существует, пока она не названа. В этом смысле определение понятия системы существует с 1929 года, когда бельгийский физик Р.Дефей предложил все известные материальные системы классифицировать по характерным особенностям их связи с внешней средой. Исходя из предложенной классификации, он назвал изолированными такие системы, которые полностью обособлены от окружающего мира (например, вулкан в состоянии покоя). Закрытыми называл системы, имеющие с внешней средой только лишь энергетический обмен (например, светящаяся электрическая лампочка или живой светлячок). И, наконец, к открытым относил системы, обменивающиеся с внешней средой и энергией и веществом (вулкан в стадии извержения или функционирующий живой организм). Этот, на первый взгляд сугубо терминологический шаг, оказался для развития термодинамики -принципиальным.
Конечно же, открытые системы существовали и до Дефея. Окружающий мир с момента зарождения состоял из того, что просто существует без движения (камень, стол, забор...) и из того, что существует за счет движения (волна, ветер, река...). К последним и относится все живое (в т.ч. и биота - совокупность растительных и животных организмов, объединенных общей территорией их распространения), поскольку, как известно: «Жизнь - это движение».
Одним из первых биологов, кого привлекла концепция открытых систем, был австрийский ученый Людвиг фон Берталанфи. В начале 30-х годов прошлого века он создал новое научное направление, получившее название «общей теории систем». Правда, еще в 1913 году в России (а в 20-х годах в Германии) была издана книга А.А. Богданова «Всеобщая информационная наука» с аналогичными взглядами, но прямых ссылок на нее у Берталанфи, к сожалению, нет.
Один из соратников Берталанфи - экономист К. Боулдинг попытался дать первую классификацию типов существующих систем, где последние расположены по возрастающей, в зависимости от степени сложности взаимосвязей и организации. В его представлении она выглядела следующим образом:
статистические системы => простые динамические системы => простые кибернетические системы => открытые системы=> царство растений => царство животных => человек => социальные организации.
При этом даже он, экономист, понимал, что открытые системы служат рубежом, отделяющим живое от неживого. Вместе с тем, между жизнью биологической и жизнью «технической» всех других открытых систем есть, как известно, кардинальное отличие. Начиная жить, все живое непрестанно удлиняет свое прошлое и сокращает будущее. Все открытые системы и, в частности, все живое существуют до тех пор, пока функционируют. Но лишь для жизни биологических систем конец функционирования означает и полное исчезновение. В технике же (неживая материя) открытые системы могут неоднократно переходить из состояния активной «жизни» в неактивное состояние «энергетической смерти» и обратно.
Первоначально исследования открытых систем проводились в рамках классической термодинамики Карно, такими известными учеными физиками, как Клаузиус, Больцман и Гиббс. Однако развиваемые ими представления оказались несовершенным инструментом для изучения открытых систем. Появилась настоятельная необходимость в новой методологии. Так были заложены основы термодинамики необратимых процессов для изучения собственно открытых систем. Существенный вклад в это направление внес и наш соотечественник И.Р. Пригожий - автор фундаментальных работ по неравновесной термодинамике. Теория открытых систем сыграла большую роль в понимании физической сущности биоэнергетических процессов, которые трудно объяснимы с точки зрения термодинамического равновесия.
Основные законы химической термодинамики
Как известно, движение является неотъемлемым свойством материи, это форма ее существования. Движение материи проявляется в разных физических и биологических формах, качественно отличающихся друг от друга, но взаимосвязанных между собой и превращающихся друг в друга.
Мерой движения является энергия. Внутренняя энергия ( ) системы есть сумма потенциальной энергии взаимодействия всех частиц тела между собой (включая электроны) и кинетической энергии их движения. Абсолютная величина внутренней энергии тела неизвестна, так как до сих пор неизвестна величина энтропии (S), однако для применения законов химической термодинамики к изучению химических явлений достаточно знать только изменение внутренней энергии (
) системы есть сумма потенциальной энергии взаимодействия всех частиц тела между собой (включая электроны) и кинетической энергии их движения. Абсолютная величина внутренней энергии тела неизвестна, так как до сих пор неизвестна величина энтропии (S), однако для применения законов химической термодинамики к изучению химических явлений достаточно знать только изменение внутренней энергии (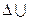 ) системы при переходе из одного состояния в другое.
) системы при переходе из одного состояния в другое.
Во многих процессах передача внутренней энергии может осуществляться частично в виде теплоты (Q), а частично в виде выполненной работы (А). Таким образом, физические понятия теплота и работа характеризуют качественно и количественно две различные формы передачи энергии от одного тела к другому, от одного организма к другому.
Взаимосвязь между внутренней энергией, теплотой и выполненной работой устанавливает первое начало термодинамики. Постулат, вытекающий из многовекового практического опыта человечества, связанный законом сохранения энергии, гласит: энергия никуда не исчезает и не возникает из ничего, а лишь переходит из одной формы в другую в строго эквивалентных количествах. Математически это выражают так:
Q = ∆U+A (1)
При этом величины ∆U,Q и А могут иметь как положительное, так и отрицательное значения в зависимости от характера изучаемого процесса. Если, например, все три величины отрицательны, то это означает, что отданная системой внешней среде теплота равна убыли внутренней энергии плюс выполненная системой работа. Для различного характера процессов, протекающих в системах, вышеприведенное уравнение 1 можно записать следующим образом:
при P=const - Qp=∆U+p∆V=∆H
при V=const - Qv=∆U
при T=const - QT=∆U+RTlnV1/V2 или
QT=∆U+RTlnP1/P2
Первое начало термодинамики позволяет решить многие практические вопросы, связанные с количественным определением теплоты и работы в различных физических, химических и биохимических процессах и в различных типах систем. Различают процессы обратимые и необратимые. К необратимым относят такие процессы, после протекания которых систему и окружающую среду нельзя одновременно вернуть в исходное состояние. Все биологические процессы - всегда необратимы и, следовательно, в биологических системах, стремящихся к максимальной энтропии ^происходит выравнивание интенсивных параметров, т.е. осуществляется более равномерное распределение энергии и вещества. Эти процессы называют диссипацией (рассеиванием) энергии. Необратимые процессысвязаны с передачей теплоты или беспорядочным движением молекул и протекают в направлении, которое приближает систему к состоянию равновесия.
Энергетические процессы у высших организмов развиваются в экзотермических условиях, когда вся теплота не может переходить в работу, поэтому известная часть энергии биосистемы должна быть связанной - о чем говорит второе начало термодинамики. Однако, известно, что: «никакая совокупность процессов не может сводиться только к превращению теплоты в работу, тогда как превращение работы в теплоту может быть единственным результатом процессов» (Томпсон).
Второе начало термодинамики - это общий закон природы, действие которого распространяется на самые разные системы. Оно носит статистический характер и применимо только к системам из бесконечно большого числа частиц, т.е. к системам, поведение которых подчиняется законам статистики. Из второго начала термодинамики следует вывод о существовании у термодинамических систем новой функции состояния -энтропии, имеющей размерность [кДж /град]. Она представляет собой тепловую энергию, рассеянную при определенной температуре или сумму энергетических потерь, приходящихся на градус в данном температурном интервале. Энтропия - это мера беспорядка системы и для необратимых процессов она равна:
dS > δQ/T (2)
Интересно, что взаимосвязь между энтропией и вероятностью описывается математическим уравнением вида:
S=AlnW + B (3)
где А и В - постоянные, W- вероятность события.
Это уравнение помогает оценить также и вероятность ожидаемого биологического процесса.
Если известно изменение энтропии системы и ее внешней среды, то возможно предсказание самопроизвольно протекающих процессов. Другими словами для этого мы должны измерить и соотнести значения ∆Sсистемы (∆SС) и ∆S внешней среды (∆S cр).
С учетом вышесказанного становится вполне очевидным, что если для данной системы сумма ∆SС+∆S ср=0, то система находится в состоянии равновесия; если же сумма ∆SС+∆S ср >0, то превращение может протекать даже самопроизвольно без дополнительного расходования энергии; если же ∆SС-∆S ср< 0, то самопроизвольно процесс вообще не может протекать.
В то же время, несмотря на то, что знание функции энтропии чрезвычайно полезно при решении вопроса возможности протекания процессов, практические трудности, связанные с экспериментальным измерением обратимых изменений в системе и внешней среде, делают ее использование в высшей степени неудобным. Например, растения и животные самопроизвольно развиваются в весьма сложно организованные структуры, что казалось бы, противоречит второму началу термодинамики и самому понятию энтропии. Однако, не следует забывать, что все живые организмы - системы самоорганизующиеся и по мере роста земных организмов, беспорядок (энтропия) таких систем все время уменьшается. Это кажущееся противоречие нивелируется беспрестанным расходом огромного количества внутренней энергии живых биосистем.
По-видимому, всем известно, что такая открытая система как Солнце, первичный источник почти всей энергии на Земле, самопроизвольно, беспрерывно и расточительно расходует себя (и энергию и вещество). Только мизерная часть энергии Солнца улавливается биосферой Земли и утилизируется, а остальная, большая часть, попавшей на Землю энергии рассеивается в далекие области Вселенной, где она практически навсегда теряется для нас. Какие именно изменения во внешней среде (Вселенной) вызывает эта рассеянная энергия мы, пока еще, не знаем.
Всякие естественные процессы сопровождаются возрастанием энтропии Вселенной, что соответствует запасанию энергии при все более низких температурах, таким образом можно сказать, что естественные процессы характеризуются понижением качества энергии. Любое действие ведет к понижению качества энтропии Вселенной. Поскольку в промышленном развитом (урбанизованном) обществе процесс использования природных ресурсов стремительно растет, то и общая энтропия Вселенной также беспрерывно возрастает. Если бы возбуждения атомов переносились целенаправленно, то система могла бы вернуться в прошлое, но они происходят беспорядочно, а хаос не может преодолеть хаос - разве что по закону случайных чисел.
Как уже отмечалось ранее, энергия реальной Вселенной способна рассеиваться столь многочисленными способами, что при этом могут возникать и образовываться самые необычные структуры, тогда как Вселенная в целом необратимо движется к достижению максимальной энтропии и состоянию равновесия. Но необратимость естественных изменений определяется не строго механической, а скорее вероятностной детерминированностью; вот почему, при этом всегда остается некая лазейка для разного рода околонаучных "чудес".
Из вышесказанного следует, что использование функции энтропии в качестве единственного критерия самопроизвольности процесса часто становится некорректным и абсолютно невозможным, поскольку для этого необходимо учесть еще и изменения, происходящие во внешней (окружающей изучаемую систему) среде.
Еще первые исследователи в области термодинамики
обнаружили и другие термодинамические функции, которые при
некоторых небольших ограничениях могут служить критерием
самопроизвольности происходящих в системах превращений.
Самой полезной из них оказалась свободная энергия (предложенная Дж. Уилордом Гиббсом) - полезная часть внутренней энергии, которая способна произвести работу. Свободная энергия Гиббса (G) согласно этому определению математически выражется так::
G = Н-Т·S (4).
Приращение (изменение) же свободной энергии системы в изотермических условиях (при T=const) будет равняться:
∆G=∆H-T∆S (5).
Отсюда следует, что приращение свободной энергии зависит от суммы приращений энтальпии (∆Н) и энтропии (∆S). В биологических же системах, где благодаря саморегуляции, обычно постоянны и давление и объем, можно записать, что ∆Н = ∆U. Отсюда следует, что как уменьшение энтальпии (внутренней энергии), так и увеличение энтропии безусловно способствуют уменьшению величины свободной энергии данной системы, от чего и зависит возможность самопроизвольного протекания реакции (процесса) в данном направлении.
Определенная таким образом свободная энергия является функцией, которую естественно можно использовать в расчетах состояния изотермических и изобарических биологических систем при T и Р - const. При этом, нужно помнить, что если для данной системы ∆G < 0, то реакция (процесс) может протекать самопроизвольно; если же ∆G > О, то реакция (процесс) вообще не идет; если же ∆G = 0, то система находится в равновесии и вообще не может ни приобретать, ни терять свободную энергию.
Понятно также, что если уменьшается свободная энергия, то совершается работа; ее принято называть полезной работой. Она может быть химической, электрической, фотохимической, осмотической. Однако, для того, чтобы система совершила работу, необходимо наличие градиента (теплового, электрического, концентрационного или любого др.).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 586; Нарушение авторских прав?; Мы поможем в написании вашей работы!