
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства алкинов
|
|
|
|
Типичными реакциями для алкинов являются реакции электрофильного присоединения. Отличие алкинов от алкенов заключается в том, что реакции присоединения могут протекать в две стадии, более медленно и, как правило, требуют присутствия катализатора. Снижение реакционной способности алкинов по сравнению с алкенами обусловлено большей прочностью тройной связи за счет меньшей длины и более симметричного распределения электронной плотности.
4.3.1. Реакция галогенирования
Взаимодействие алкинов с галогенами протекает ступенчато, при этом сначала образуются транс- дигалогеналкены, а затем тетрагалогеналканы:
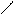
 Br H
Br H

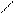
 HC≡CH + Br2 C = C
HC≡CH + Br2 C = C
H Br
транс -1,2-дибромэтен
 CHBr=CHBr + Br2 CHBr2−CHBr2
CHBr=CHBr + Br2 CHBr2−CHBr2
1,1,2,2-тетрабромэтан
Алкины, так же как и алкены, обесцвечивают бромную воду.
4.3.2. Реакция гидрогалогенирования
Эти реакции, как правило, проводят в присутствии катализаторов. Для несимметричных алкинов на каждой стадии присоединение идет по правилу Марковникова:
AlBr3
 CH3−C≡CH + HBr CH3−CBr=CH2
CH3−C≡CH + HBr CH3−CBr=CH2
пропин 2-бромпропен
 CH3−CBr=CH2 + HBr CH3−CBr2−CH3
CH3−CBr=CH2 + HBr CH3−CBr2−CH3
2,2-дибромпропан
4.3.3. Реакция гидратации (реакция Кучерова)
Вода присоединяется к алкинам с образованием неустойчивых продуктов − енолов, которые быстро изомеризуются в карбонильные соединения. Реакция протекает в присутствии сульфата ртути HgSO4:
Hg2+

 R−C ≡C−R1 + H2O [ R−CH = C−R1 ] R−CH2−C=O
R−C ≡C−R1 + H2O [ R−CH = C−R1 ] R−CH2−C=O
| |
OH R1
неустойчивая «кето-форма»
«енольная форма»
Реакция гидратации ацетилена по Кучерову имеет промышленное значение, в результате образуется уксусный альдегид:
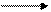
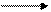 CH ≡CH + H2O [ CH2=CH] CH3−C=O
CH ≡CH + H2O [ CH2=CH] CH3−C=O
| |
OH H
виниловый спирт уксусный альдегид
4.3.4. Взаимодействие со спиртами
К реакциям электрофильного присоединения относится и реакция получения виниловых эфиров:
 R−C ≡C−R + R1−OH R−CH=C−R
R−C ≡C−R + R1−OH R−CH=C−R
|
OR1
 HC ≡CH + CH3OH CH2=C−OCH3
HC ≡CH + CH3OH CH2=C−OCH3
|
H метилвиниловый эфир
4.3.4. Реакция гидрирования
Реакция присоединения водорода к алкинам протекает в присутствии катализатора (Ni, Pd, Pt) с образованием ненасыщенных и насыщенных соединений. Реакцию можно остановить на стадии получения алкенов.

 HC≡CH + H2 CH2=CH2 CH2=CH2 + H2 CH3−CH3
HC≡CH + H2 CH2=CH2 CH2=CH2 + H2 CH3−CH3
этин этен этан
4.3.5. Реакции полимеризации
В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются разные продукты. Так, в водном растворе CuCl и NH4Cl ацетилен димеризуется, давая винилацетилен:
 HC≡CH + HC≡CH CH2=CH−C≡CH
HC≡CH + HC≡CH CH2=CH−C≡CH
винилацетилен
В присутствии активированного угля при 600 ºС происходит тримеризация ацетилена с образованием бензола:
 |
 3 HC≡CH
3 HC≡CH
4.3.6. Реакции замещения водорода
Атом водорода, находящийся у углерода в sp -гибридном состоянии, достаточно подвижен и способен замещаться на атомы металлов. Поэтому алкины, в отличие от алкенов, способны образовывать соли – ацетилениды:
 СН≡СН + NaNH2 СН≡ СNa + NH3
СН≡СН + NaNH2 СН≡ СNa + NH3
ацетиленид натрия
 HC≡CH + 2 [Ag(NH3)2]OH Ag−C≡C−Ag↓ + 2 NH3 + 2 H2O
HC≡CH + 2 [Ag(NH3)2]OH Ag−C≡C−Ag↓ + 2 NH3 + 2 H2O
ацетиленид дисеребра
Ацетилениды тяжелых металлов Ag, Cu, Hg представляют собой не истинные соли, а ковалентно построенные соединения, нерастворимые в воде, взрывоопасные в сухом виде.
4.3.7. Окисление алкинов
а) реакция горения:
 2 С2Н2 +5 О2 4 CO2 + 2 H2O
2 С2Н2 +5 О2 4 CO2 + 2 H2O
При горении ацетилена в кислороде температура достигает 2800º − значительно выше, чем при горении других углеводородов; это объясняется небольшим содержанием водорода в ацетилене, а следовательно, и образованием при горении небольшого количества воды, обладающей большой теплоемкостью.
б) взаимодействие с окислителями:
Алкины легко окисляются различными окислителями, в частности, перманганатом калия; раствор KMnO4 обесцвечивается, что служит указанием на наличие тройной связи. При окислении алкинов обычно происходит расщепление тройной связи с образованием карбоновых кислот:
 R−C≡C−R/ + 3 [O] + H2O R−COOH + R/−COOH
R−C≡C−R/ + 3 [O] + H2O R−COOH + R/−COOH
Ацетилен в этой реакции образует углекислый газ и воду:
KMnO4, H+
 CH ≡CH 2 CO2 + H2O
CH ≡CH 2 CO2 + H2O
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1472; Нарушение авторских прав?; Мы поможем в написании вашей работы!