
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Первые члены гомологического ряда альдегидов – газ и низкокипящие жидкости:
|
|
|
|
Физические свойства
Первые члены гомологического ряда альдегидов – газ и низкокипящие жидкости:
H−C=O CH3−C=O CH3−CH2−C=O
| | |
H H H
Т. кип. = −21ºС Т. кип. = 20,2ºС Т. кип. = 48,8ºС
Температуры кипения альдегидов и кетонов значительно ниже, чем соответствующих спиртов. Причина заключается в том, что карбонильные соединения не в состоянии образовать эффективные водородные связи вследствие слабой поляризации связи C—H:
спирты альдегиды
δ+ δ− δ+ δ− δ+ δ− δ+ δ−
H—O ... H—O R−C=O H−C=O
| | | |
R R H R
Δχ(O—H) = 1,4 Δχ(C—H) = 0,4
Низшие альдегиды имеют резкий запах, у альдегидов с числом атомов углерода от 3 до 6 весьма неприятный запах, высшие альдегиды обладают цветочными запахами и применяются в парфюмерии.
Химические свойства альдегидов и кетонов определяются наличием в их составе карбонильной группы с полярной двойной связью. Электронная плотность связи C = O смещена в сторону более электроотрицательного атома кислорода:
δ/+ δ+ δ/+
R — CH2 → C ← CH2 — R/
 || δ−
|| δ−
O
Как и в случае двойной С=С связи, для связи С=О характерны реакции присоединения, однако протекают они не по электрофильному, а по нуклеофильному механизму (AN). Активность альдегидов и кетонов в реакциях присоединения определяется величиной положительного заряда на атоме углерода карбонильной группы. Электронодонорные группы, связанные с группой С=О, уменьшают величину этого заряда. Поэтому кетоны, карбонильная группа которых связана с двумя электронодонорными углеводородными радикалами, менее активны, чем альдегиды.
Кроме того, сильно поляризованная карбонильная группа оказывает существенное влияние на водородные атомы, находящиеся у соседних с карбонильной группой атомов углерода – они приобретают повышенную реакционную способность.
5.1. Реакции присоединения:
а) присоединение водорода (восстановление)
t, Ni
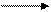 R−CH=O + H2 R−CH2−OH
R−CH=O + H2 R−CH2−OH
При взаимодействии альдегидов с водородом получаются первичные спирты, кетоны в этой реакции образуют вторичные спирты.
б) присоединение циановодородной (синильной) кислоты
KCN
 CH3−CH=O + H−CN CH3−CH−OH
CH3−CH=O + H−CN CH3−CH−OH
|
CN
Образовавшееся соединение – оксинитрил (циангидрин) содержит на один атом углерода больше, чем исходный альдегид или кетон, поэтому подобные реакции используются для удлинения углеродной цепи. Оксинитрилы легко превращаются в α-гидрокси- и α-аминокислоты.
в) получение бисульфитных производных


 R R OH
R R OH


 C = O + NaHSO3 C
C = O + NaHSO3 C
H H SO3Na
Гидросульфитные соединения – кристаллические вещества, которые при нагревании с разбавленными кислотами разлагаются с образованием исходных альдегидов. Они служат для выделения альдегидов и кетонов из их смесей с другими веществами и получения их в чистом виде.
г) образование ацеталей
В присутствии каталитических количеств безводных кислот к альдегидам легко присоединяются спирты с образованием ацеталей:
H+ CH3OH, H+

 R−C=O + HOCH3 R −CH−OH R−CH−OCH3
R−C=O + HOCH3 R −CH−OH R−CH−OCH3
| | −H2O |
H OCH3 OCH3
Эта реакция играет важную роль в превращении линейных форм углеводов в циклические.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 634; Нарушение авторских прав?; Мы поможем в написании вашей работы!