
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Применение
|
|
|
|
Формальдегид используют для получения полимерных материалов (фенолформальдегидных смол). В водном растворе формальдегида (формалине) хранят анатомические препараты. Ацетальдегид применяют для получения различных соединений алифатического ряда — уксусной кислоты, уксусного ангидрида, этилового эфира уксусной кислоты и т.д. Ацетон используют как растворитель для лаков, красок и т.д.
Вопросы для закрепления темы:
1. Какие классы соединений с карбонильной группой известны?
2. Каковы общие формулы альдегидов, кетонов?
3. Какие виды изомерии характерны для альдегидов и кетонов?
4. Каковы тривиальные названия первых трех гомологов альдегидов?
5. В чем различие физических свойств альдегидов и кетонов? Каковы причины этих различий?
6. Каковы способы получения альдегидов и кетонов?
7. Каковы химические свойства предельных альдегидов?
8.Какие меры предосторожности необходимо соблюдать при работе с альдегидами?
Лекция №24-25: Карбоновые кислоты. Состав и строение. Изомерия, номенклатура. Свойства. Применение и получение.
Карбоновыми кислотами называются соединения, содержащие карбоксильную группу
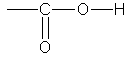
Классификация. По числу карбоксильных групп карбоновые кислоты делят на одноосновные (одна группа -СООН), двухосновные (две группы -СООН) и т.д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими (например, уксусная или акриловая), алициклическими (например, циклогексанкарбоновая) или ароматическими (бензойная, фталевая).
| Формула | Систематическое название | Тривиальное название |
| HCOOH | метановая | муравьиная |
| CH3COOH | этановая | уксусная |
| C2H5COOH | пропановая | пропионовая |
| C6H5COOH | бензойная | - |
| CH3(CH2)16COOH | октадециловая | стеариновая |
| HOOC-COOH | этандиовая | щавелевая |
| HOOC-CH2-COOH | пропандиовая | малоновая |
| HOOC-CH2CH2-COOH | бутандиовая | янтарная |
Если в углеводородном радикале карбоновых кислот атом (атомы) водорода замещен на другие функциональные группы, то такие кислоты называются гетерофункционапьными. Среди них различают галогенкарбоновые (например, CH2Cl—COOH), нитро-кислоты (например, NO2—С6Н4СООН), аминокислоты, оксикислоты (например, молочная СН3—СН(ОН)—СООН) и др.
Карбоновые кислоты с числом атомов углерода выше 6 называют высшими (жирными) кислотами. Название "жирные" эти кислоты получили потому, что большинство из них могут быть выделены из жиров.
Строение. Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы ОН. Свойства карбоксильной группы отличаются от свойств составляющих ее групп, которые оказывают взаимное влияние друг на друга. В группе СО атом углерода несет частичный положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается, и связь О-Н ослабляется:
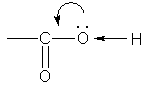
В свою очередь, группа ОН "гасит" положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Номенклатура. В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая кислота. Низшие карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная, масляная и др.
Углеводородную цепь нумеруют, начиная с атома углерода карбоксильной группы, например:
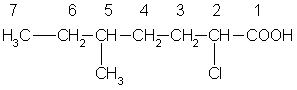
2-хлор-5-метилгептановая кислота
CH3—CH=CH—COOH
бутен-2-овая кислота
Часто карбоксильную группу рассматривают как заместитель в молекуле углеводорода. При этом в названии употребляют словосочетание "карбоновая кислота" и в нумерацию атомов углерода цепи атом углерода карбоксильной группы не включают:
9 8
СН3(СН2)7СН=СН(СН2)7СООН
Гептадецен-8-карбоновая (олеиновая) кислота
Названия дикарбоновых кислот производят от названия соответствующего углеводорода с добавлением суффикса "диовая" и слова "кислота". Например, этандиовая (щавелевая) кислота (НООС-СООН).
Изомерия. У карбоновых кислот возможны следующие виды изомерии:
1. Изомерия углеродной цепи. Она начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров:
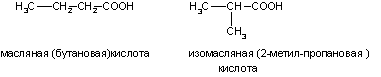
2. Изомерия положения кратной связи, например:
СН2=СН—СН2—СООН СН3—СН=СН—СООН
Бутен-3-овая кислота Бутен-2-овая кислота
(винилуксусная кислота) (кретоновая кислота)
3. Цис-транс- изомерия, например:
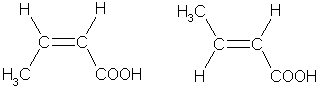
цис -бутен-2-овая транс-бутен-2-овая
кислота кислота
4. Межклассовая изомерия: например, масляной кислоте (СН3—СН2—СН2—СООН) изомерны метиловый эфир пропановой кислоты (СН3—СН2—СО—О—СН3) и этиловый эфир уксусной кислоты (СН3—СО—О—СН2—СН3).
Физические свойства. Насыщенные алифатические монокарбоновые кислоты образуют гомологический ряд, который характеризуется общей формулой CnH2n+1 COOH. Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный "уксусный" запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 17 °С она замерзает, превращаясь в льдистое вещество, которое получило название "ледяная" уксусная кислота. Средние представители этого гомологического ряда — вязкие, "маслообразные" жидкости; начиная с С10 — твердые вещества. Кислоты, содержащие 1-3 углеродных атома, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость монокарбоновых кислот уменьшается, твердые высшие жирные кислоты в воде не растворяются. В жидком состоянии и в неводных растворах молекулы монокарбоновых кислот димеризуются в результате образования между ними водородных связей. Это объясняет гораздо более высокие температуры кипения карбоновых кислот по сравнению со спиртами и альдегидами с тем же числом атомов углерода; температуры плавления и кипения с ростом молекулярной массы возрастают.
Химические свойства. Карбоновые кислоты обладают всеми свойствами обычных кислот. Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот:
2RCOOH + Мg → (RCOO)2Mg + Н2,
2RCOOH + СаО → (RCOO)2Ca + Н2О,
RCOOH + NaOH → RCOONa + Н2О,
RCOOH + NaHCO3→ RCOONa + Н2О + СО2↑.
Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:
CH3COONa + HCl → СН3СООН + NaCl.
Соли карбоновых кислот в водных растворах гидролизованы:
СН3СООК + Н2О → СН3СООН + КОН.
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных. Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
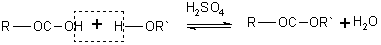
Гидролиз в щелочной среде необратим и приводит к образованию солей карбоновых кислот, например:
R-CO-OR' + NaOH → R-CO-ONa + R'OH.
Ряд свойств карбоновых кислот обусловлен наличием углеводородного радикала. При действии галогенов на кислоты в присутствии красного фосфора образуются галогензамещенные кислоты, причем на галоген замещается атом водорода при соседнем с карбоксильной группой атоме углерод:
СН3-СН2-СООН + Вr2 → СН3-СНВr-СООН + НВr
Карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже углеводороды:
2[Н]
СН3СООН → СН3СНО + Н2О
4[Н]
СН3СООН →СН3СН2ОН + Н2О
6[Н]
СН3СООН →С2Н6 + 2Н20
Муравьиная кислота дает реакцию «серебряного зеркала»:
НСООН + Аg2О → 2Аg + СО2 + Н2О.
Кроме того, муравьиная кислота окисляется хлором:
НСООН + Сl2 → СО2 + 2HCl.
В атмосфере кислорода карбоновые кислоты окисляются до СО2 и Н2О:
СН3СООН + 2О2 → 2СО2 + 2Н2О.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 462; Нарушение авторских прав?; Мы поможем в написании вашей работы!