
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изомерия
|
|
|
|
Способы получения.
1. Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот. В качестве окислителей применяются KМnО4 и K2Сr2О7.
[O] [O]
R-CH2-OH →R-CH=O→R-CO-OH
Спирт альдегид кислота
2. Другой общий способ — гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода. При этом образуются спирты, содержащие группы ОН у одного атома углерода — такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
ЗNаОН
R-CCl3 → [R-C(OH)3] → R-COOH + Н2О
-3NaCl
3.Гидролиз сложных эфиров:
R-COOR1 + КОН → R-COOK + R'OH,
Вопросы для закрепления темы:
1. Какие вещества называют карбоновыми кислотами?
2. Какова классификация карбоновых кислот?
3. Какие виды изомерии характерны для предельных одноосновных карбоновых кислот?
4. Особенности номенклатуры предельных одноосновных карбоновых кислот.
5. Каковы способы получения предельных одноосновных карбоновых кислот?
6. Каковы физические свойства карбоновых кислот в сравнении со спиртами и альдегидами?
7. Каково строение карбоновых кислот?
8. Какие факторы влияют на силу карбоновых кислот?
9. Каковы химические свойства предельных одноосновных карбоновых кислот?
10. Приведите примеры производных карбоновых кислот.
11. Как изменяются кислотные свойства в ряду: одноатомные спирты – фенолы – карбоновые кислоты?
12. Каковы особые свойства муравьиной кислоты?
13. Каковы основные области применения кислот?
Лекция №26: Сложные эфиры. Жиры. Мыло и СМС.
Среди функциональных производных карбоновых кислот особое место занимают сложные эфиры — соединения, представляющие карбоновые кислоты, у которых атом водорода в карбоксильной группе заменен углеводородным радикалом. Общая формула сложных эфиров
R - C - O - R'
||
O
где R и R' — углеводородные радикалы (в сложных эфирах муравьиной кислоты R — атом водорода).
Названия сложных эфиров производят от названия, углеводородного радикала и названия кислоты, в котором вместо окончания "-овая кислота" используют суффикс "ат", например:
CH3 - C- O - C2H5
||
O
Этилацетат
СН3-СН = СН -C -О-СН3
||
O
метилбутен - 2 - ат
Часто сложные эфиры называют по тем остаткам кислот и спиртов, из которых они состоят. Так, рассмотренные выше сложные эфиры могут быть названы: этановоэтиловый эфир, кротоновометиловый эфир.
Для сложных эфиров характерны три вида изомерии:
1. Изомерия углеродной цепи, начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например:
СН3- СН2-СН2-СН2-С - О-С2Н5
||
O
этилбутират
СН3- СН-СН2 -C-О-С2Н5
| ||
CH3 O
этилизобутират
2. Изомерия положения сложноэфирной группировки -СО-О-. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например:
СН3-СО-О-С2Н5 С2Н5-СО-О-СН3
Этилацетат метилпропионат
3. Межклассовая изомерия, например:
СН3-СО-О-СН3 С2Н5-СО-ОН
Метилацетат пропионовая кислота
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи; цис-транс-изомерия.
Физические свойства. Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, малорастворимые или практически нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т.д.
Сложные эфиры имеют, как правило, более низкую температуру кипения, чем соответствующие им кислоты. Например, стеариновая кислота кипит при 232 °С (Р = 15 мм рт. ст.), а метилстеарат— при 215 °С (Р =15 мм рт. ст.). Объясняется это тем, что между молекулами сложных эфиров отсутствуют водородные связи.
Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде нерастворимы, хорошо растворимы в органических растворителях. Например, пчелиный воск представляет собой в основном мирицилпальмитат (C15H31COOC31H63).
Химические свойства. Реакция гидролиза или омыления.
Реакция этерификации является обратимой, поэтому в присутствии кислот будет протекать обратная реакция, называемая гидролизом, в результате которой образуются исходные жирные кислоты и спирт:

Реакция гидролиза катализируется и щелочами, в этом случае гидролиз необратим:

так как получающаяся карбоновая кислота со щелочью образует соль:
R – COOH + NaOH → R – COOH + H2O
2. Реакция присоединения.
Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения. Например, при каталитическом гидрировании они присоединяют водород.
3. Реакция восстановления.
Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
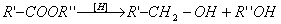
4. Реакция образования амидов.
Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
R'-CO-OR" + NH3 → R'-CO-NH2 + R"OH.
Жиры являются сложными эфирами, образованными высшими одноосновными карбоновыми кислотами, главным образом пальмитиновой, стеариновой (насыщенные кислоты) и олеиновой (ненасыщенная кислота) и трехатомным спиртом - глицерином. Общее название таких соединений - триглицериды
Природные жиры представляют собой не индивидуальное вещество, а смесь различных триглицеридов.
Образование одного из триглицеридов, например триглицерида стеариновой кислоты, можно изобразить уравнением
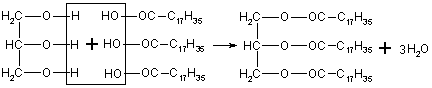
глицерин стеариновая кислота стеариновый триглицерид
В состав молекул триглицеридов могут входить разнородные кислотные радикалы, что особенно характерно для природных жиров, однако остаток глицерина является составной частью всех жиров:

Все жиры легче воды и в ней нерастворимы. Они хорошо растворяются в бензине, эфире, тетрахлориде углерода, сероуглероде, дихлорэтане и других растворителях. Хорошо впитываются бумагой и кожей. Жиры содержатся во всех растениях и животных. Жидкие жиры обычно называются маслами. Твердые жиры (говяжий, бараний и др) состоят главным образом из триглицеридов предельных (твердых) кислот, жидкие (подсолнечное масло и др.) - из триглицеридов непредельных (жидких) кислот.
Жидкие жиры превращаются в твердые путем реакции гидрогенизации. Водород присоединяется по месту разрыва двойной связи в углеводородных радикалах молекул жиров:

Реакция протекает при нагревании под давлением и в присутствии катализатора - мелко раздробленного никеля. Продукт гидрогенизации - твердый жир (искусственное сало), называется саломасом идет на производство мыла, стеарина и глицерина. Маргарин - пищевой жир, состоит из смеси гидрогенизованных масел (подсолнечного, хлопкового и др.), животных жиров, молока и некоторых других веществ (соли, сахара, витаминов и др.).
Важное химическое свойство жиров, как и всех сложных эфиров, - способность подвергаться гидролизу (омылению). Гидролиз легко протекает при нагревании в присутствии катализаторов - кислот, щелочей, оксидов магния, кальция, цинка:

Реакция гидролиза жиров обратима. Однако при участии щелочей она доходит практически до конца - щелочи превращают образующиеся кислоты в соли и тем самым устраняют возможность взаимодействия кислот с глицерином (обратную реакцию).
Жиры - необходимая составная часть пищи. Они широко используются в промышленности (получение глицерина, жирных кислот, мыла).
Мыла - это соли высших карбоновых кислот. Обычные мыла состоят главным образом из смеси пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли - жидкие мыла.
Мыла получаются при гидролизе жиров в присутствии щелочей:
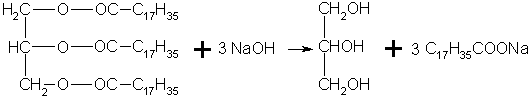
триглицерид стеариновой Глицерин Стеарат натрия
кислоты (тристеарин) (мыло)
Отсюда реакция, обратная этерификации получила названия реакции омыления,
Омыление жиров может протекать и в присутствии серной кислоты (кислотное омыление). При этом получаются глицерин и высшие карбоновые кислоты. Последние действием щелочи или соды переводят в мыла.Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров - синтетические карбоновые жирные кислоты с большой молекулярной массой.
Производство мыла требует больших количеств сырья, поэтому поставлена задача получения мыла из непищевых продуктов. Необходимые для производства мыла карбоновые кислоты получают окислением парафина. Нейтрализацией кислот, содержащих от 10 до 16 углеродных атомов в молекуле, получают туалетное мыло, а из кислот, содержащих от 17 до 21 атома углерода, - хозяйственное мыло и мыло для технических целей. Как синтетическое мыло, так и мыло, получаемое из жиров, плохо моет в жесткой воде. Поэтому наряду с мылом из синтетических кислот производят моющие средства из других видов сырья, например из алкилсульфатов - солей сложных эфиров высших спиртов и серной кислоты.
В общем виде образование таких солей можно изобразить уравнениями
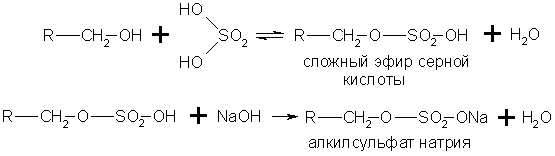
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Синтетические моющие средства высвобождают сотни тысяч тонн пищевого сырья - растительных масел и жиров.
Вопросы для закрепления темы:
1. Какие вещества называются сложными эфирами?
2. Какие виды изомерии характерны для них?
3. Что называется реакцией омыления?
4. Какие способы получения сложных эфиров вы знаете?
5. Как решить проблему получения мыла?
6. Что называется СМС?
7. Какой вред наносит использование СМС окружающей среде?
8. Как подразделяются жиры?
9. Какую биологическую роль выполняют жиры в организме человека?
Лекция № 27-28: Моносахариды. Глюкоза и фруктоза. Строение. Свойства. Дисахариды и полисахариды. Сравнение свойств крахмала и целлюлозы.
Впервые термин «углеводы» был предложен профессором Дерптского (нынеТартуского) университета К.Г. Шмидтом в 1844 г. В то время предполагали, что все углеводы имеют общую формулу Cm(H2O)n, т.е. углевод + вода. Отсюда название «углеводы». Например, глюкоза и фруктоза имеют формулу С(Н2О)6, тростниковый сахар (сахароза) C12(H2O)11, крахмал [С6(Н2О)5]n и т.д. В дальнейшем оказалось, что ряд соединений, по своим свойствам относящихся к классу углеводов, содержат водород и кислород в несколько иной пропорции, чем указано в общей формуле (например, дезоксирибоза С5Н10О4). В 1927 г. Международная комиссия по реформе химической номенклатуры предложила термин «углеводы» заменить термином «глициды», однако старое название «углеводы» укоренилось и является общепризнанным.
Химия углеводов занимает одно из ведущих мест в истории развития органической химии. Тростниковый сахар можно считать первым органическим соединением, выделенным в химически чистом виде. Произведенный в 1861 г. A.M. Бутлеровым синтез (вне организма) углеводов из формальдегида явился первым синтезом представителей одного из трех основных классов веществ (белки, липиды, углеводы), входящих в состав живых организмов. Химическая структура простейших углеводов была выяснена в конце XIX в. в результате фундаментальных исследований Э. Фишера. Значительный вклад в изучение углеводов внесли отечественные ученые А.А. Колли, П.П. Шорыгин, Н.К. Кочетков и др. В 20-е годы нынешнего столетия работами английского исследователя У. Хеуорса были заложены основы структурной химии полисахаридов. Со второй половины XX в. происходит стремительное развитие химии и биохимии углеводов, обусловленное их важным биологическим значением.
Классификация.
Углеводы можно определить как альдегидные или кетонные производные полиатомных (содержащих более одной ОН-группы) спиртов или как соединения, при гидролизе которых образуются эти производные.
Согласно принятой в настоящее время классификации, углеводы подразделяются на три основные группы: моносахариды, олигосахариды и полисахариды.
Моносахариды можно рассматривать как производные многоатомных спиртов, содержащие карбонильную (альдегидную или кетонную) группу. Если карбонильная группа находится в конце цепи, то моносахарид представляет собой альдегид и называется альдозой; при любом другом положении этой группы моносахарид является кетоном и называется кетозой.
Простейшие представители моносахаридов – триозы: глицеральдегид и диоксиацетон. При окислении первичной спиртовой группы трехатомного спирта – глицерола – образуется глицеральдегид (альдоза), а окисление вторичной спиртовой группы приводит к образованию диоксиацетона (кетоза).
Глюкоза — моносахарид, одна из восьми изомерных альдогексоз. Молярнаямасса 180 г/моль. Глюкоза в виде D-формы (декстоза, виноградный сахар) является самым распространённым углеводом. D-глюкоза (обычно её называют просто глюкозой) встречается в свободном виде и в виде олигосахаридов (тростниковый сахар, молочный сахар), полисахаридов (крахмал, гликоген, целлюлоза, декстран), гликозидов и других производных. В свободном виде D-глюкоза содержится в плодах, цветах и других органах растений, а также в животных тканях (в крови, мозгу и др.). D-глюкоза является важнейшим источником энергии в организмах животных и микроорганизмов. Как и другие моносахариды D-глюкоза образует несколько форм. Кристаллическая D-глюкоза получена в 2-х формах: a-D-глюкоза (рисунок 1) и b-D-глюкоза (рисунок 2).

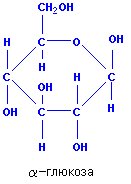
В особом виде глюкоза содержится почти во всех органах зелёных растений. Особенно её много в виноградном соке, поэтому глюкозу иногда называют виноградным сахаром. Мёд в основном состоит из смеси глюкозы с фруктозой.
В организме человека глюкоза содержится в мышцах, в крови (0.1 - 0.12 %) и служит основным источником энергии для клеток и тканей организма. Повышение концентрации глюкозы в крови приводит к усилению выработки гормона поджелудочной железы — инсулина, уменьшающего содержание этого углевода в крови. Химическая энергия питательных веществ, поступающих в организм, заключена в ковалентных связях между атомами. В глюкозе количество потенциальной энергии составляет 2800 кДж на 1 моль (то есть на 180 грамм).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 872; Нарушение авторских прав?; Мы поможем в написании вашей работы!