
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия
|
|
|
|
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Все протекающие в природе процессы следуют первому началу термодинамики, но не всякий процесс, не противоречащий первому началу, осуществим на практике. Из первого начала вытекает лишь, что энергия изолированной системы постоянна, определить же направление процесса, происходящее в системе, нельзя.
Второй закон термодинамики, так же как и первый, не может быть найден из каких-либо общих положений, и устанавливается на основании опыта. Он дает возможность разделить все допускаемые первым законом процессы на самопроизвольно и несамопроизвольно протекающие в данных условиях. Второй закон устанавливает, какой процесс может протекать и в каком направлении в данной системе при рассматриваемых условиях без сообщения энергии извне, т.е. самопроизвольно, каков предел его протекания и какое количество работы может быть получено при этом.
Было предложено несколько формулировок второго закона термодинамики.
Карно(1824) - в тепловых машинах теплота, полученная от теплоисточника, не может быть полностью переведена в механическую работу, часть ее должна быть передана третьему телу - холодильнику.
Клаузиус(1850) - теплота не может переходить от холодного тела к горячему сама собой.
Кельвин(1854) - невозможно превратить в работу теплоту какого-либо тела, не производя никакого другого действия,кроме охлаждения этого тела.
Оствальд - осуществление вечного двигателя второго рода невозможно. Под вечным двигателем второго рода подразумевается такая периодически действующая тепловая машина, которая способна была бы полностью превращать теплоту в работу, т.е. без передачи части ее холодильнику.
Односторонность протекания процессов в природе является следствием молекулярной природы вещества. Рассмотрим поведение молекул в закрытом сосуде, разделенном перегородкой. Вероятность нахождения молекул в одной части сосуда будет мала, а вероятность равномерного распределения всех
молекул по объему - велика.
Математически для одной молекулы вероятность равна 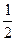 ,а для N молекул равна (
,а для N молекул равна (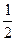 )N. Эта величина мала. Каждое состояние может быть охарактеризовано определенной вероятностью. При этом равновесию отвечает наибольшая вероятность и следовательно, вероятность данного состояния является тем критерием, который определяет направление процесса и позволяет найти равновесие.
)N. Эта величина мала. Каждое состояние может быть охарактеризовано определенной вероятностью. При этом равновесию отвечает наибольшая вероятность и следовательно, вероятность данного состояния является тем критерием, который определяет направление процесса и позволяет найти равновесие.
В термодинамике используют понятие термодинамической вероятности, равное числу способов, каким может быть осуществлено данное состояние. Обозначается W. Она является функцией состояния и максимальна при равновесии.
Сложная система из 2-х систем с вероятностью W1 и W2 будет иметь вероятность W12 = W1 W2.Такое свойство, когда целое является произведением составляющих называется мультипликативностью. В термодинамике надо иметь такую функцию вероятности, котoрая была бы связана с тепловыми характеристиками, обладала свойствами аддитивности и принимала экстремальные значения при равновесии. Для этого введена функция - энтропия.
S = f(W1 W2) = f(W1) + f(W2)
S = k lnW
S12 = k ln(W1 W2) = k ln W1 + ln W2 = S1 + S2
Рассмотрим расширение газа от объема V1 до V2 и определим изменение энтропии.
DS = S2 – S1 = k ln 
 =
= 
DS = k NA ln 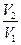
Q = RT ln 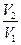
DS = k 
k Na = R k - константа Больцмана
DS = 
dS = 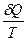
Из первого закона
dQ = dU + dW
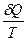 =
= 
dS = 
dU = TdS – dW - объединенное выражение первого и второго закона термодинамики.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 294; Нарушение авторских прав?; Мы поможем в написании вашей работы!