
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория валентных связей
|
|
|
|
ПРИМЕНЕНИЕ МЕТОДА МО К ДВУХАТОМНЫМ МОЛЕКУЛАМ
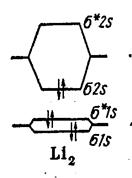
Молекула Li2 Li 1s2 2s1
Молекула Ве2 Be 1s2 2s2
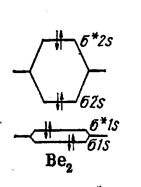
Связь не должна образовываться
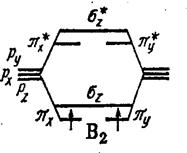
Молекула В2 В 1s2 2s2 2p1
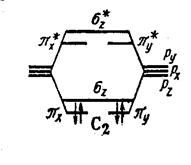
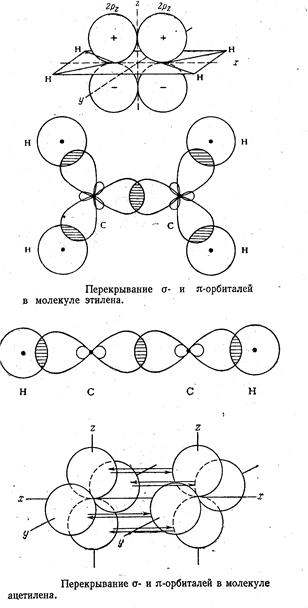
Молекула С2 С 2s2 2p2
Молекула N2 N 2s2 2p3
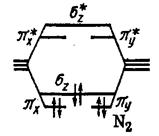
Молекула О2 О 2s2 2p4
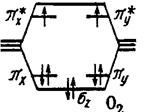
Молекула F2 F 2s2 2p5
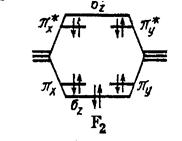
Молекула Ne2 Ne 2s2 2p6
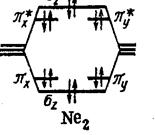
Молекулы Ne2 не существует
Сущность теории валентных связей состоит в том, что неспаренный электрон на орбитали одного атома, например Рх-орбитали, находится в состоянии обменного взаимодействия с неспаренным электроном на орбитали соседнего атома (1S).
Ответственным за образование связи считаются два электрона с противоположными спинами, принадлежащими двум соседним атомам. Это соответствует связи, образованной обобществленной
парой электронов.
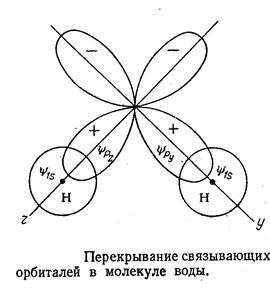
Наиболее строгий подход в рамках метода валентных связей, позволяющий получать лучшее приближение к экспериментальному значению, основан на концепции гибридизации. В основе этого подхода лежит замена набора водородoподобных атомных орбиталей новыми волновыми функциями.
В качестве примера рассмотрим гибридизацию одной S-орбитали с одной Р-орбиталью с образованием гибридных SP-орбиталей.
Процесс гибридизации можно представить математически как сложение отдельных волновых функций.
В случае SP-гибридизации две результирующие волновые функции имеют вид:
y1 = 1/√2(ys + yp)
y2 = 1/√2(ys - yp)
Гибридные орбитали имеют вид:
ysp = 1/√2(ys ± yp)

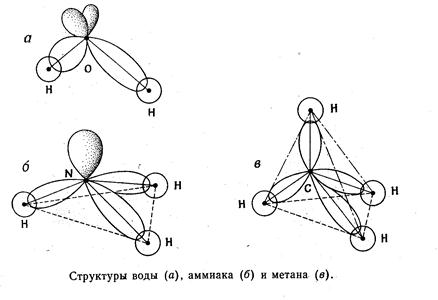
Использование двух таких равноценных гибридных орбиталей должно приводить к линейной молекуле. Три гибридные орбитали, образованные из одной S и двух Р-орбиталей по форме аналогичны и ориентированы друг к другу под углом 120°
Наиболее часто встречается SP3-гибридизация.
Волновые функции имеют вид
y1 = 1/2(ys + ypx + ypy + ypz)
y2 = 1/2(ys + ypx - ypy - ypz)
y3 = 1/2(ys - ypx + ypy - ypz)
y4 = 1/2(ys - ypx - ypy + ypz)
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 309; Нарушение авторских прав?; Мы поможем в написании вашей работы!