
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 6. Химическая кинетика и катализ
|
|
|
|
План
1. Скорость химических реакций.
2. Энергия активации.
3. Необратимые и обратимые реакции. Химическое равновесие.
4. Понятие о катализе и катализаторах.
1. Химическая кинетика – это раздел физической химии, изучающий скорость химических реакций. Скорость химической реакции равна изменению концентрации реагирующих веществ в единицу времени в единице реакционного пространства. Рассмотрим в общем виде скорость реакции, протекающей по уравнению А + В = АВ. По мере израсходывания вещества А скорость реакции уменьшается. Скорость реакции может быть определена лишь для некоторого промежутка времени. Концентрация вещества А в момент времени t1 измеряется величиной с1, а в момент времени t2 – величиной с2. То за промежуток времени Δt = t2 - t1 изменение концентрации вещества составит Δс = с2 - с1. Тогда истинная скорость равна: υ = + 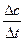 . Скорость химической реакции имеет единицу измерения: моль/ (л·с).
. Скорость химической реакции имеет единицу измерения: моль/ (л·с).
Факторы, влияющие на скорость химических реакций. Скорость химических реакций зависит от природы реагирующих веществ и условий протекания реакций: концентрации, температуры, давления, присутствия катализаторов. Скорость химической реакции пропорциональна произведению концентрации реагирующих веществ (основной закон химической кинетики).
Влияние температуры на скорость химической реакции подчиняется правилу Вант-Гоффа. При повышении температуры на каждые 10 оС скорость большенства реакций увеличивается в 2-4 раза.
скорость большенства реакций увеличивается в 2-4 раза.
2. Скорость химической реакции определяется числом столкновений, в которых принимают участие активные молекулы (частицы), обладающие энергией, достаточной для осуществления данной реакции. Неактивные частицы можно сделать активными, сообщив им дополнительную энергию. Этот процесс называется активацией. Активировать молекулы можно например повышением температуры. Энергия которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации (Еа).
Рассмотрим в общем виде ход реакции А2 + В2 = 2АВ. Чтобы реагирующие вещества А2В2 образовали продукт реакции АВ, они должны преодолеть энергетический барьер С. На это затрачивается энергия активации. При этом в ходе реакции из частиц реагирующего вещества образуется промежуточная переходная группировка, называемая переходным состоянием или активированным комплексом. Последующий распад активированного комплекса приводит к образованию конечных продуктов реакции АВ.
3. Реакции, которые протекают только в одном направлении и завершаются полным превращением реагирующих веществ в конечные вещества, называются необратимыми. Например, разложение бертолетовой соли при нагревании:
2КСIO3 + 2КCI + 3O2 
Обратимыми называют такие реакции, которые одновременно протекают в двух взаимно-противоположных направлениях – прямом и обратном. Например, образование и разложение иодоводорода:
Н2 + I2  2HI
2HI
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия. Состояние системы реагирующих веществ, при котором скорости прямой и обратной реакции равны между собой, называется состоянием химического равновесия.
Смещение химического равновесия. Принцип Ле-Шателье. Если на систему находящуюся в состоянии химического равновесия, оказывается внешнее воздействие (изменяется температура, давление, концентрация), то положение равновесия смещается в сторону, противоположную данному воздействию. Рассмотрим это на примере реакции синтеза аммиака:
3 Н2 + N2  2NH3
2NH3
Если внешнее воздействие выражается в увеличении концентрации азота и водорода, то химическое равновесие смещается в сторону образования аммиака. Увеличение концентрации аммиака смещает равновесие в сторону исходных веществ.
4. Скорость химических реакций можно увеличить с помощью катализаторов. Катализаторами называют вещества, изменяющие скорость химических реакций. Сам катализатор в реакциях не расходуется и в конечные продукты не входит. Явление изменения скорости реакции под воздействием катализаторов называется катализом. Одни катализаторы значительно ускоряют химическую реакцию – положительный катализ, а другие замедляют – отрицательный катализ (ингибирование). Вещества, замедляющие скорость химических реакций называют ингибиторами. Примером положительного катализа является увеличение скорости разложения бертолетовой соли в присутствии оксида марганца (IV). Примером отрицательного катализа является уменьшение скорости разложения пероксида водорода в присутствии небольших доз серной кислоты.
Различают два вида катализа – гомогенный и гетерогенный. Особенность гомогенного катализа является то, что реагирующие вещества и катализатор находятся в одном и том же фазовом состоянии. Примером газовой гомогенной каталитической реакции является разложение оксида углерода (II) в присутствии паров воды. При гетерогенном катализе реагирующие вещества и катализатор образуют систему их разных фаз. Например, гидрирование этилена в присутствии никелевого катализатора.
Механизм действия катализаторов. Если в медленно протекающую реакцию А + В = АВ ввести катализатор К, то катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя промежуточное соединение: А + К = АК. Затем промежуточное соединение АК взаимодействует с другим исходным веществом, при этом катализатор освобождается: АК + В = АВ + К. Например, окисление SO2 в SO3 с участием катализатора NO.
При изучении свойств катализаторов установлено, что их поверхность неоднородна. На ней имеются активные центры на которых и протекают каталитические реакции. Некоторые вещества снижают активность катализаторов. Такие вещества называют каталитическими ядами. Например, соединения мышьяка, ртути, свинца угнетают активность платиновых катализаторов. Имеются вещества, которые усиливают действие катализаторов. Их называют промоторами (добавки железа и алюминия для платиновых катализаторов).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1198; Нарушение авторских прав?; Мы поможем в написании вашей работы!