
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 7. Электрохимические процессы
|
|
|
|
План
1. Предмет электрохимии. Электроды.
2. Возникновение потенциала на границе металл-раствор.
3. Гальванический элемент Даниэля-Якоби.
4. Аккумуляторы.
1. Электрохимия – это раздел физической химии, в котором изучаются процессы превращения химической и электрической энергии. Электрохимические процессы протекают на границе раздела фаз (металл-раствор) с участием заряженных частиц. Эти процессы имеют большое практическое значение и используются при работе химических источников тока, для нанесения защитных покрытий, получения и очистки металлов.
Электродом в электрохимии называют систему, состоящую из токопроводящего вещества и раствора (расплава) электролита, в который погружается это вещество. Простейшим примером электрода является металл, погруженный в водный раствор соли этого металла - медная пластинка, погруженная в раствор сульфата меди (II). В качестве электрода сравнения используют стандартный водородный электрод, потенциал которого приравнивается к нулю.
2. Металл, погруженный в раствор электролита, представляет собой токопроводящую систему. При этом, между электродом и раствором электролита возникает разность потенциалов, называемая электродным потенциалом. Возникновение разности потенциалов на границе металл-раствор обусловлено протеканием электродных процессов. Электродные процессы представляют собой окислительно-восстановительные реакции. Механизм этих процессов заключается в следующем. При контакте металла с раствором ионы кристаллической решетки металла притягиваются полярными молекулами воды и переходят в раствор, заряжая его положительно, а металл, в котором появился избыток электронов, заряжается отрицательно. При этом между металлом и раствором устанавливается разность потенциалов.
|
|
|
3. Химический гальванический элемент – это устройство, в котором энергия химической реакции преобразуется в электрическую энергию. Наиболее простейшим является гальванический элемент Даниэля-Якоби. Он состоит из стандартных цинкового и медного электродов. Электроды погружены соответственно в растворы ZnSO4 и CuSO4. Цинковый электрод заряжен отрицательно, а медный положительно.
Схему элемента можно записать следующим образом:
(-) Zn I ZnSO4 II CuSO4 I Cu (+)
При замыкании цепи протекают следующие процессы:
1) реакция окисления цинка Zn -2e 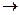 Zn2+
Zn2+
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называются анодами;
2) реакция восстановления ионов меди Сu2+ +2e 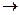 Cu
Cu
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами;
3) движение электронов по внешней цепи;
4) движение ионов в растворе: анионов (SO42-) к аноду, катионов (Сu2+, Zn2+) к катоду.
Основной характеристикой гальванического элемента является его электродвижущая сила (ЭДС). ЭДС элемента Даниэля-Якоби равна:
Е = ЕСu - EZn
Стандартная ЭДС элемента Даниэля-Якоби равна 1,1 В.
4. В качестве источников постоянного тока в работе наиболее эффективны гальванические элементы многоразового использования – аккумуляторы. Рассмотрим работу свинцового аккумулятора. Он состоит их погруженных в раствор серной кислоты свинцового электрода и электрода из свинца, который покрыт слоем оксида свинца (IV). При работе аккумулятора на электроде без покрытия происходит реакция окисления:
Рl + SO42- -2e = Рl SO4
На электроде, покрытом слоем окислителя, протекает процесс восстановления:
PlO2 + 4H+ + SO42- + 2e = Рl SO4 + 2H2O
Суммарная реакция: PlO2 + Рl + 2H2SO4 = 2Рl SO4 + 2H2O
|
|
|
Пропуская электрический ток через разряженный аккумулятор, его можно снова полностью зарядить. В процессе зарядки аккумулятора сульфат свинца (II) удаляется с электродов и они приобретают исходную форму.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1148; Нарушение авторских прав?; Мы поможем в написании вашей работы!