
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Спектр электромагнитного излучения
|
|
|
|
СПЕКТРАЛЬНЫЕ МЕТОДЫ АНАЛИЗА
Спектральные методы анализа основаны на регистрации спектров испускания или поглощения атомов и молекул и измерении интенсивности электромагнитного излучения в узком энергетическом диапазоне. Методы спектрального анализа подразделяются на радиочастотную, оптическую, рентгеновскую и др. виды спектрометрии в зависимости от того, в какой области электромагнитного спектра проводятся измерения.
Электромагнитное излучение может быть охарактеризовано либо волновым, либо энергетическим параметрами. Все эти величины взаимосвязаны и выбор той или иной величины определяется удобствами при работе.
Волновой параметр выражается длиной волны l (м, см, мкм, нм или Å), частотой колебаний n (с-1 или герц, 1 Гц = 1 с-1), либо волновым числом uu (м-1, см-1). В некоторых книгах волновое число обозначают знаком  . Частота электромагнитных колебаний n связана с длиной волны l соотношением n = c/l, где с - скорость света в вакууме, равная 2.997925∙108 м/с (приближенно 3∙108 м/с). В спектроскопии принято называть частотой также и волновое число u = 1/ l, показывающее, сколько длин волн умещается на интервале 1 см (т.е. если l = 10-5 м = 10-3 см, то u = 1000 см-1). В нарушение требования об использовании системы СИ волновые числа измеряют по-прежнему в обратных сантиметрах (см-1). 1 см ≡ 11.9631 Дж /моль.
. Частота электромагнитных колебаний n связана с длиной волны l соотношением n = c/l, где с - скорость света в вакууме, равная 2.997925∙108 м/с (приближенно 3∙108 м/с). В спектроскопии принято называть частотой также и волновое число u = 1/ l, показывающее, сколько длин волн умещается на интервале 1 см (т.е. если l = 10-5 м = 10-3 см, то u = 1000 см-1). В нарушение требования об использовании системы СИ волновые числа измеряют по-прежнему в обратных сантиметрах (см-1). 1 см ≡ 11.9631 Дж /моль.
Частота линии спектра поглощения связана с разностью энергий Δ Е возбужденного и основного состояний:
ΔЕ= hν = Евозб. - Еосн.,
где h – константа Планка (h = 6.626·10-34 Дж·с).
Как следует из вышеприведенной формулы кванты излучения с более короткой длиной волны (с более высокой частотой) имеют более высокую энергию.
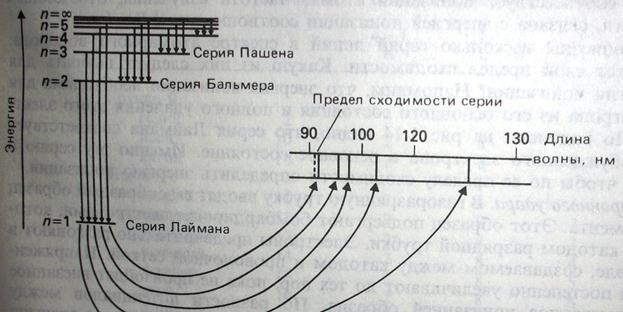
Рис.1. Схема квантования энергии электрона в атомарном водороде (на схеме не указаны р - и d – подуровни). Энергия электрона с главным квантовым числом n = 1 соответствует основному состоянию атома (1 s 1). Другие состояния (2s1, 3s1, 4s1, ….) – возбужденные. Переход электрона из возбужденных состояний 2s1, 3s1, 4s1, … на уровень 1s1 соответствует серии Лаймана, из состояний 3s1, 4s1, … на уровень 2s1 - серии Бальмера и т.д.
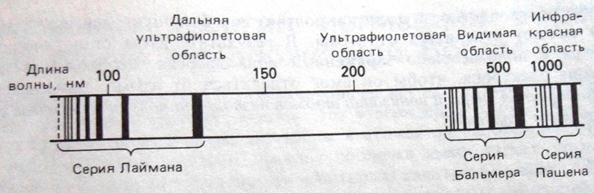
Рис. 2. Спектр испускания атомарного водорода - светлые линии и полосы на черном фоне. черные линии на белом фоне. Спектры поглощения выглядят иначе – черные линии и полосы (на том же самом месте) на белом фоне. белые линии и полосы на черном фоне. Расширение линий связано с
Спектр электромагнитного излучения
Е кванта→
n →
← λ
| 105 | 3∙10-4 | 8∙10-7 | 4∙10-7 | 10-8 | 10-12 | l, м | |||||||||||||
| Радиочастотная область | Микроволновая область | Инфракрасная область | Видимое излучение | Ультрафиолетовая область | Рентгеновское излучение | g - излучение космические лучи | |||||||||||||
| Вращательный спектр | К-вр. | Электронный спектр | Изменения | Изменения | |||||||||||||||
| Изменение энергетического состояния спинов электронов (ЭПР - спектроскопия). Изменение энергетического состояния спинов ядер (ЯМР - спектроскопия) | Колебательно - вращательный спектр (колебания атомов в молекуле). ИК - спектроскопия | Изменения в энергетическом состоянии внешних (валентных) электронов (Спектроскопия в УФ и видимой области, КР - спектроскопия) | в энергетическом состоянии внутренних электронов атомов (Рентгеноско-пия) | в энергетическом состоянии ядер (ядерно- физические методы анализа) | |||||||||||||||
Электромагнитный спектр простирается от жесткого g- излучения с очень короткой длиной волны до длинных радиоволн. Каждая из областей спектра связана с определенными видами внутримолекулярных движений, процессами в атомах и ядрах. При поглощении или испускании квантов света изменяется энергия электронов в электронных оболочках атомов и молекул, энергия колебания атомных ядер в молекуле и энергия вращения молекулы.
Все виды внутримолекулярных движений взаимосвязаны, но для каждого из них существует определенный набор допустимых (разрешенных) значений энергии.
1.1.1 Молекулярные спектры испускания, поглощения и комбинационного (см.п 1.4) рассеяния
Современное учение о спектрах электромагнитного излучения базируется на квантовой теории, согласно которой атомная система является устойчивой лишь в определенных стационарных состояниях, соответствующих некоторой дискретной последовательности значений энергии. Переход между двумя квантовыми состояниями 1 « 2 с энергиями Е 1 и Е 2 приводит к поглощению (абсорбции), E1 < E2, или испусканию (эмиссии), E1 > E2, энергии в виде электромагнитного излучения с частотой n, определяемой уравнением Бора:
DE = |E1 - E2 | = hn,
где E1 и E2 - энергия начального и конечного состояний соответственно, hh - постоянная Планка, n - частота поглощаемого или испускаемого излучения. h = 6.616 10-34 Дж∙с
Согласно уравнению частот Бора в спектре возникает линия с частотой (с-1)
n = |E1 - E2 | /h
или с волновым числом (см-1)
u = |E1 - E2 | /hc.
Переходы с нижнего энергетического уровня на верхний порождают спектр поглощения (абсорбции), с верхнего на нижний - спектр испускания (эмиссии) (рис.2).
В оптико - спектрометрических методах анализа используют дискретность энергетических уровней молекул и испускание или поглощение излучения, которое связано с переходом молекулы или атома с одного энергетического уровня на другой (Рис.1). Энергию квантов света в спектроскопии выражают в обратных сантиметрах, учитывая, что 1 см-1 ≡ 11.9631 Дж/моль. Наиболее высокую энергию имеют кванты, возникающие при электронных переходах (от 40 до 400 кДж/моль), затем следуют колебательные кванты (от 4 до 40 кДж/моль) и затем вращательные, с самой малой энергией (0.4 - 4 кДж/моль). Электронный переход одновременно сопровождается колебательными и вращательными переходами, т.е. представляет собой электронно - колебательно - вращательный переход. (рис.3).
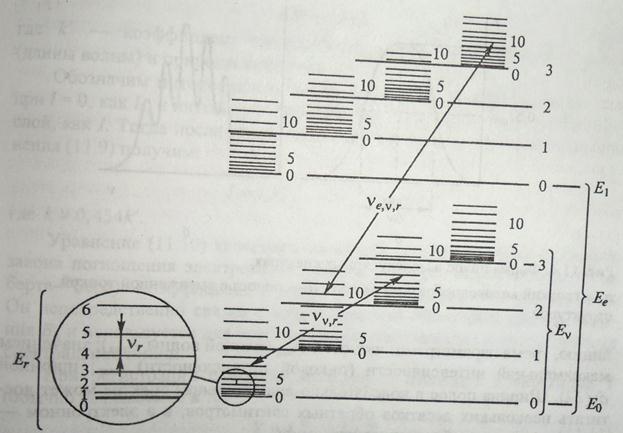
Рис. 31. Схема энергетических уровней двухатомной молекулы: Е е - уровни энергии электронов; Еv – уровни колебательной энергии (vibration – вибрация, колебание): Е r – уровни вращательной энергии (rotation –вращение): vevr – переходы, соответствующие электронно – колебательно - вращательному спектру: vv r - переходы, соответствующие колебательно-вращательному спектру; vr – переходы, соответствующие вращательному спектру. [Золотов. Основы аналитической химии. Книга 2. с.207]
Энергия кванта такого перехода выражается формулой
e эл.-кол.-вр = e эл + e кол + e вр = hn эл + hn кол + hn вр,
а частота соответствующей линии в спектре равна сумме частот (это одна линия):
n эл.-кол.-вр = n эл + n кол + n вр.
Для краткости электронно – колебательно - вращательный спектр называют просто электронным спектром. Он состоит из множества серий полос в УФ и видимой области. Каждая серия отвечает одному электронныому переходаму с более высоких уровней на какой-либо ниже расположенный (рис.1). Энергия квантов, возбуждающих такие переходы, повторим, лежит в области 40 ÷ 400 кДж/моль. Волновые числаЧастоты νu квантов электронныхого переходова лежат в диапазоне (3.3 ÷ 33.3)∙103 см-1, что соответствует длинам волнт.е. l от 0.3 до 3 мкм.
Кванты более низкой энергии в области 4 ÷ 40 кДж/моль отвечают переходам между колебательными уровнями. При этом неизбежно происходит и изменение вращательных состояний, еще более низких по энергии, и возникает колебательно-вращательный спектр. Энергия перехода и частота линий в колебательно-вращательном спектре связаны соотношениями:
eкол.-вр = eкол + eвр = hnкол + hnвр.
nкол.-вр = nкол + nвр.
При данном колебательном переходе с частотой nкол возникает полоса, отдельные линии которой отвечают разным комбинациям слагаемых в сумме n кол + n вр. Волновые числа u Частоты колебательных квантов n простираются от 30 до 4000 см-1 (l от 2.5 мкм до 0.3 мм). Это далекая инфракрасная область, вплотную смыкающаяся с областью миллиметровых радиоволн.
Кванты еще более низкой энергии (0.4 ÷ 4 кДж/моль) могут вызывать только переходы между вращательными уровнями и дают начало чисто вращательному спектру. Энергии перехода и частоты во вращательном спектре связаны соотношением
eвр = hnвр.
Каждая линия в таком спектре имеет частоту nвр, отвечающую i -му вращательному переходу. Вращательный спектр имеет частоты порядка 10-1 ÷ 1 см-1 и простирается в область субмиллиметровых (МВ - микроволновая область) и сантиметровых (СВЧ - сверхвысокочастотная область) радиоволн.

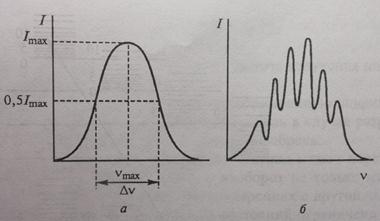
Рис.3.Форма полос в молекулярных спектрах: а - гладкий колокообразный контур; б – полоса с выраженной тонкой структурой. Характеристики полосы: I max, v max, Δ v. Спектральная полоса –это совокупность близко расположенных спектральных линий, образующихся в результате наложения на электронный переход сопутствующих ему колебательных и вращательных переходов.
Контур спектральной полосы в молекулярных спектрах может быть гладким колокообразным или обнаруживать тонкую структуру (рис.3). Полосу без разрешенной тонкой структуры принято характеризовать, как и спектральную линию, тремя параметрами: частотой nmax (длиной волны lmax); значением максимальной интенсивности (пиковой интенсивности) I max; шириной Δ v (Δ λ). Ширина полос в колебательно-вращательном спектре может достигать нескольким десятков обратных сантиметров, а в электронном – несколько тысяч обратных сантиметров.
1.1.2 Возбуждение спектра
Энергетическое воздействие на вещество может осуществляться тепловым, электромагнитным, химическим и другими путями. Все эти воздействия приводят к испусканию веществом электромагнитных излучений. Энергия излучается в виде линейчатого спектра, характеризующегося дискретными значениями длин волн. При прохождении излучения сплошного спектра через вещество, напротив, происходит поглощение энергии и образуется спектр поглощения, также характеризующийся дискретными значениями длин волн. Отношение интенсивностей полосы, отвечающей одному и тому же переходу m «n, в спектре поглощения (абсорбции) Ia и спектре испускания (эмиссии) Ie различно и зависит от частоты перехода. Теория приводит к соотношению
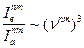 ,
,
т.е. интенсивность испускания Ie во много раз превосходит интенсивность поглощения Ia в области высоких частот 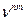 . Поэтому спектры испускания удобнее изучатьизучают в видимой и ультрафиолетовой области. В области малых частот (ИК- и СВЧ- области) удобнее изучать спектры поглощения. На этих частотах, наоборот, интенсивнее спектры абсорбции.
. Поэтому спектры испускания удобнее изучатьизучают в видимой и ультрафиолетовой области. В области малых частот (ИК- и СВЧ- области) удобнее изучать спектры поглощения. На этих частотах, наоборот, интенсивнее спектры абсорбции.
С другой стороны, спектры испускания известны для атомов (изучены атомные спектры) и лишь сравнительно небольшого числа достаточно простых молекул. Поэтому молекулярные спектры изучают главным образом как спектры поглощения, когда излучение источника сплошного спектра (например, лампы накаливания) проходит через кювету, наполненную раствором вещества. Так как каждый структурный элемент молекулы поглощает энергию только в характерной для него области, то определив частоту и количественно оценив интенсивность поглощаемого излучения можно установить структуру соединения (качественный анализ) и определить количество исследуемого вещества (количественный анализ).
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1748; Нарушение авторских прав?; Мы поможем в написании вашей работы!