
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекулярно - абсорбционный спектральный анализ в видимой и УФ области спектра
|
|
|
|
Молекулярно - абсорбционный спектральный анализ включает в себя фотоколориметрический и спектрофотометрический методы. Оба метода основаны на общем принципе - существовании линейной зависимости между светопоглощением и концентрацией поглощающего вещества.
Фотоколориметрический анализ основан на поглощении излучения с полихроматическим спектром, который выделяется с помощью светофильтров. Количество вещества определяется по интенсивности окраски или светопоглощению окрашенных соединений (реже применяемый колориметрический анализ основан на сравнении интенсивности окрасок исследуемого окрашенного раствора и стандартного окрашенного раствора с точно известной концентрацией). Фотоколориметрические методы используют сравнительно несложную аппаратуру и обеспечивают хорошую точность (относительная погрешность 1÷ 2 %).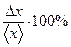
Спектрофотометрический анализ основан на определении спектра поглощения и измерении светопоглощения при определенной длине волны (монохроматическое излучение), которая соответствует максимуму на кривой поглощения данного вещества. В спектрофотометрических методах применяют более сложные приборы, позволяющие проводить анализ как окрашенных, так и бесцветных соединений по избирательному поглощению монохроматического света в ультрафиолетовой, видимой или инфракрасной областях спектра. Характеризуется высокой точностью - относительная погрешность 0.5 ÷ 1%.
(См. также п.1.2.3).
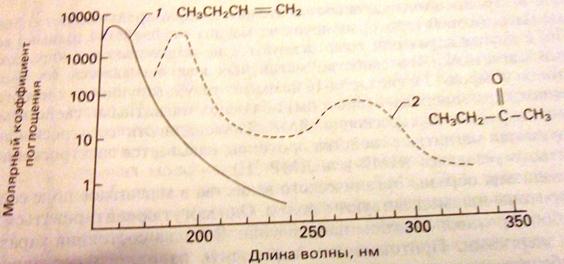
Рис.4. Спектрофотометрмческий анализ. Ультрафиолетовый спектр поглощения (зависимость поглощения электромагнитной энергии) бутена-1 (1) и бутанона (2). (зЗависимость поглощения электромагнитной энергии бутеном-1 (1) и бутаноном (2) в УФ-области от длины волны излучения.) По оси ординат отложен молярный коэффициент поглощения ελ. По виду этих зависимостей можно идентифицировать поглощающие вещества. [Фримантл. Химия в действии. Ч.2, с.333.]
|
|
|
В абсорбционном анализе наиболее важное значение имеют электромагнитные излучения со следующими длинами волн:
а) «вакуумная» ультрафиолетовая область спектра с длинами волн до 190 нм (1 нм = 10 А =10-7 см);
б) ультрафиолетовая область спектра с длинами волн между 190 и 400 нм (области 190 ÷300 нм называют дальней ультрафиолетовой, 300 ÷400 нм - ближней ультрафиолетовой);
в) видимая область спектра (400 ÷ 760 нм);
г) инфракрасная область спектра (760 ÷ 20 000 нм).
Природа поглощения в УФ и видимой областях спектра определяется, главным образом, числом и расположением электронов в поглощающих молекулах и ионах. В инфракрасной области она в большей степени связана с колебаниями атомов в молекулах поглощающего вещества.
1.2.1 Качественный анализ вещества
Способность органических веществ к поглощению света обусловливается, в основном, наличием в них π - связей. Функциональную группу молекулы, содержащую π – связь, называют хромофором. Хромофорами являются карбонильная группа = С = О (содержится в кетонах R – CО – R, λmax ≈ 271 нм; альдегидах R-C(O)H, λmax ≈ 293 нм: карбоновых кислотах R - COOH, λmax≈ 204 нм), амидах R - C(O)NH3, (λmax ≈ 208 нм), этилене Н2С = СН2, (λmax ≈ 193 нм), нитрогруппах С-NO2, (λmax ≈ 271 нм). Положение максимума спектральной линии поглощения функциональной группой точно не фиксировано и зависит от молекулярного окружения хромофора, растворителя, рН, температуры раствора. Наличием электронных переходов, приводящих к поглощению света в видимой области спектра (400 ÷ 760 нм), характеризуются ионы переходных металлов.
Справка. π – связи образуются при перекрывании рz – атомарных орбиталей.
|
|
|
ХЭС. С.670. Хромофоры-ненасыщенные группы N≡N, NO2, N=O, CH=СН, C=O. Отвечают за окраску соедининий.
Поскольку многие вещества обладают лишь малой способностью к поглощению света в УФ и видимой областях спектра, разработаны косвенные методы, основанные на реакциях образования окрашенных комплексов.
1.2.2 Количественный анализ. Законы поглощения света
Закон Ламберта-Бугера. Если световой поток с интенсивностью I 0 падает на кювету с раствором, то часть его отразиться от поверхности кюветы (I отр), часть будет поглощена раствором (I погл) и часть пройдет через кювету (I t).
|
|
|
|






|



Рис.5.
I0 = I + Iпогл +Iотр
Так как I отр - небольшая величина, которой можно пренебречь, то
I0 = I + Iпогл.
Связь между интенсивностями падающего светового потока и светового потока, прошедшего через слой вещества устанавливается законом Ламберта-Бугера, согласно которому однородные с лои одного и того же вещества одинаковой толщины, при прочих равных условиях, всегда поглощают одну и ту же часть падающего на них светового потока». Математически эта зависимость выражается уравнением
 ,
, 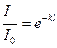
где k - коэффициент поглощения, l – длина оптического пути (толщина поглощающего слоя, обычно в см).
Коэффициент поглощения k зависит от природы растворенного вещества и длины волны падающего света. Следовательно, первый закон поглощения справедлив только для монохроматического света, т.е. для света с определенной длиной волны. Из закона Ламберта - Бугера следует, что:
а) отношение интенсивности светового потока, прошедшего через слой раствора, к интенсивности падающего светового потока не зависит от абсолютной интенсивности падающего светового потока;
б) если толщина слоя раствора увеличивается в арифметической прогрессии, интенсивность светового потока, прошедшего через него, уменьшается в геометрической прогрессии.
Закон Бера. Бер установил, что коэффициент поглощения k пропорционален концентрации поглощающего вещества, т.е.:
k = el ∙С,
где el - коэффициент, характеризующий вещество и не зависящий от его концентрации;
С - концентрация вещества.
Если концентрация С выражена в моль/л, а толщина поглощающего слоя l в см, то коэффициент el называют молярным коэффициентом поглощения (коэффициентом экстинкции). Он представляет собой величину, зависящую от длины волны падающего света, природы растворенного вещества, природы растворителя, температуры раствора.
|
|
|
Закон Ламберта-Бугера-Бера. Закон Бера рассматривает изменение поглощения светового потока слоем постоянной толщины при изменении концентрации, а закон Ламберта-Бугера - изменение поглощения светового потока раствором постоянной концентрации при изменении толщины поглощающего слоя. Эти законы аналогичны друг другу. Объединяя их, получим уравнение основного закона светопоглощения - закона Ламберта-Бугера-Бера, который лежит в основе большинства фотометрических методов анализа:
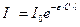 , (1)
, (1)
или в десятичной системе логарифмов
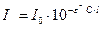 . (1*)
. (1*)
Величины e и e* связаны друг с другом соотношением e = e* ∙lg e, где lg e = 1/2.3. Ниже будем пользоваться выражением (1*) и использовать в нем для краткости вместо обозначения e* обозначение e.
Отношение интенсивности светового потока I, прошедшего через раствор, к интенсивности падающего светового потока I0 носит название прозрачности (или пропускания) и обозначается буквой Т:
Т = I / I0 =10-e∙С∙l (2)
Величина Т, отнесенная к толщине слоя в 1 см, называется коэффициентом пропускания. Пропускание обычно выражается в процентах:
Т |l=1cм = I/I0 100%. (2а)
Десятичный логарифм величины, обратной пропусканию (или прозрачности?), носит название оптической плотности или поглощения (обозначается соответственно знаком D (density) или А (absorb)).
D = lg (I0/I) = lg (100/T) = el∙С∙l. (3)
Из (3) следует, что оптическая плотность D прямо пропорциональна концентрации вещества в растворе (закон справедлив только для разбавленных растворов). Из уравнения (3) следует также, что D = el при С = 1 моль/л и l = 1 см, т.е. молярный коэффициент светопоглощения представляет собой оптическую плотность 1М раствора, помещенного в кювету с толщиной слоя 1 см. Молярный коэффициент светопоглощения отражает индивидуальные свойства окрашенных соединений и является их характеристикой. Величина молярного коэффициента светопоглощения el зависит также от длины волны проходящего света, температуры раствора и природы растворенного вещества.
|
|
|
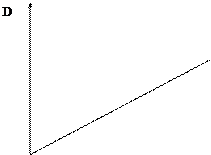
Если графически изобразить зависимость D от С, то при отсутствии поглощения света растворителем и систематических ошибок получим прямую линию, проходящую через начало координат.
 |
|
 0
0
Рис.6.
Закон Ламберта-Бугера-Бера справедлив лишь для монохроматического излучения, поэтому, чем ближе излучение к монохроматическому, тем выше точность измерений. Излучение определенной длины волны может быть выделяютено с помощью специального оптического устройства - монохроматора. В фотоколориметрии измерение интенсивности световых потоков проводят не в монохроматическом, а в узком интервале полихроматического света, выделяемом с помощью светофильтров (ширина интервала 20÷100 нм). В этом случае в уравнения (1-3) вместо молярного коэффициента светопоглощения el следует подставлять значение среднего молярного коэффициента светопоглощения, зависящее от характеристики используемого светофильтра.
Существует ряд причин отклонения от закона Ламберта-Бугера-Бера:
1. Влияние посторонних электролитов, вызывающих деформацию электронных оболочек ионов, вследствие чего изменяется поглощение света и, соответственно, оптическая плотность растворов.
2. Диссоциация окрашенных соединений в растворах. Окраска иона отличается от окраски молекулы. Интенсивность окраски, зависящая от соотношения, например, концентраций окрашенных и бесцветных частиц, изменяется с изменением общей концентрации раствора, т.к. при этом происходит и изменение степени диссоциации. В результате, при разбавлении или концентрировании растворов наблюдаются отклонения от основного закона колориметрии.
3. Многие окрашенные соединения чувствительны к концентрации ионов водорода и изменяют свою окраску с изменением рН среды. При колориметрии точное соблюдение рН среды имеет исключительное значение.
4. Процесс комплексообразования - при образовании комплексов изменяется окраска иона.
5. Окрашенные соединения часто изменяют свою окраску во времени.
6. Интенсивность окраски зависит от температуры, которая должна поддерживаться в пределах ± (1÷ 3)°С.
7. Образование окрашенного соединения часто зависит от количества, порядка добавления и концентрации реактива.
Отклонение от закона Бера оценивается относительным изменением оптической плотности окрашенного раствора при его разбавлении, получаемым при неизменном значении произведения концентрации светопоглощающего соединения на толщину слоя C∙l = const.
1.2.3 Методы измерения оптической плотности растворов
Молярный коэффициент светопоглощения ε λ окрашенного вещества и оптическая плотность D раствора различны для разных длин волн света, проходящего через окрашенный раствор. Для достижения максимальной точности и чувствительности количественных определений, измерение оптической плотности растворов желательно проводить в той области спектра, в которой поглощение является максимальным. Для получения спектра поглощения в координатах DD = f (l) или e = f (l), проводят серию измерений оптической плотности раствора или молярного коэффициента светопоглощения при различных длинах волн (через 10 ÷ 20 нм) в интересующей нас области спектра, а найдя границы максимума, промеряют эту область с меньшим шагом. По полученным данным строят кривую поглощения.
 | |||
 | |||
Рис.7.
Область максимального поглощения характеризуется размытостью максимума, т.е. интервалом длин волн (l1/2max ÷ l’1/2max), отвечающим половинным значениям максимального молярного коэффициента светопоглощения или максимальной оптической плотности раствора. Для того, чтобы из всей видимой области спектра выделить лучи с определенной длиной волны, на пути светового потока перед поглощающим раствором помещают избирательные поглотители света - светофильтры. Чем уже область максимального пропускания лучей (l1/2max ÷ l’1/2max) применяемого светофильтра, тем выше его избирательность для данного спектрального диапазона и тем точнее фотометрическое определение. Наиболее эффективные стеклянные узкополосные светофильтры характеризуются размытостью максимума пропускания 20 - 30 нм.
Аналитическая абсорбционная спектрофотометрия основана на тех же законах светопоглощения, что и фотоколориметрические методы, но в спектрофотометрии используется поглощение монохроматического света, или, точнее, очень узкого интервала волн (1 ÷ 2нм). Преимущества спектрофотометрических методов перед фотоколориметрическими:
· позволяют работать в узкой области оптимального светопоглощения, что значительно увеличивает чувствительность и точность количественного анализа;
· применимы как для анализа одного вещества, так и смеси, содержащей несколько поглощающих компонентов, химически не взаимодействующих друг с другом;
· можно работать не только с окрашенными растворами, которые поглощают свет в видимой области спектра, но и с бесцветными для глаза растворами, которые поглощают излучение в ультрафиолетовой или ближней инфракрасной областях спектра.
Требования при работе в ультрафиолетовой области спектра: использование кварцевых, а не стеклянных кювет; трудно оценивать концентрации бесцветных растворов, поэтому увеличивается число проб и разбавлений; необходимо учитывать возможность присутствия посторонних примесей в растворе, которые будут поглощать свет и мешать анализу, а также влияние растворителей на характер спектра растворенного вещества и поглощение самих растворителей в ультрафиолетовой области.
Определение концентрации вещества методом сравнения оптических плотностей эталонного и исследуемого растворов. Готовят эталонный раствор определяемого вещества известной концентрации Са, которая приближается к концентрации Сх исследуемого раствора. Определяют оптическую плотность Da этого раствора при эталонной длине волны, затем определяют оптическую плотность исследуемого раствора Dx при той же длине волны и при той же толщине слоя. Концентрацию Сх определяют по формуле
 .
.
Количество q определяемого вещества (мг) с учетом разбавления раствора находят по формуле:
q = (СxVa/Vп) Vk,
где Va - объем окрашенного раствора, мл;
Vk - общий объем исследуемого раствора, мл;
Vп - объем аликвотной части исследуемого раствора, взятой для приготовления окрашенного раствора, мл.
Справка. Аликвота – точно известная часть анализируемого раствора, взятая для анализа. Часто она отбирается квлиброванной пипеткой и ее объем обычно обозначается символом Vп.
Определение концентрации вещества в растворе по значению молярного коэффициента поглощения el. Готовят эталонный раствор исследуемого вещества определенной концентрации Сэт (моль/л) и измеряют значение его оптической плотности Dэт при длине волны l. Значение молярного коэффициента поглощения el устанавливают по формуле
el = Dэт/ (l∙Сэт).
Затем, определив значение Dx исследуемого раствора при той же длине волны и зная el, находят значение концентрации исследуемого вещества (моль/л):
сх = Dx / (el l)
Определение концентрации вещества в растворе с помощью калибровочного графика. Предварительно готовят серию растворов определяемого вещества различной концентрации (градуировочные растворы), измеряют оптические плотности этих растворов с длиной волны l и по полученным данным строят графиккривую зависимости оптической плотности раствора от концентрации. Определив значение оптическуюой плотностьи исследуемого раствора при той же толщине слоя, находят концентрацию исследуемого вещества по калибровочному графику.
 |
Рис.8.
Определение концентрации вещества в растворе дифференциальным методом. Приборы, используемые для измерения оптической плотности растворов, снабжены двумя кюветами. В кювету-1 наливают исследуемый раствор, а в кювету-2 – чистый растворитель. Если определение концентрации вещества в растворе ведется по дифференциальному методу, то в кювету-2 вместо растворителя наливают окрашенный раствор определяемого элемента с известной концентрацией С 0, т.е. раствор сравнения. Концентрация С 0 раствора сравнения должна быть меньше концентрации Сх исследуемого раствора. Оптическую плотность исследуемого раствора измеряют по отношению к раствору сравнения.
lg (I1/I2) = Dx’ = e∙l∙ (Сx - С0),
где Dx’- оптическая плотность исследуемого раствора по отношению к раствору сравнения.
1.2.4 Оборудование для спектрофотометрии
Различают две группы приборов для измерения концентрации соединения в растворе методом молекулярной абсорбции:
1. Фотоколориметрический анализ, в котором поглощение света, прошедшего сначала через светофильтр, измеряют при помощи приборов с фотоэлементом (фотоэлектроколориметров ФЭК).
2. Спектрофотометрический анализ, в котором кроме фотоэлемента используются призма или дифракционная решетка и щель. Эти устройства позволяют выделить узкий участок спектра, а именно тот, с которым оптически реагирует окрашенное соединение.
Все спектральные приборы для исследования поглощения веществ в различных областях спектра электромагнитного излучения имеют одинаковую структурную схему и отличаются лишь устройством отдельных элементов схемы. Основные блоки:
а) источник излучения, создающий электромагнитное излучение в широком диапазоне длин волн;
б) монохроматор, который включает: в) входную щель, г) диспергатор и д) выходную щель;
е) отсек для кобразца, где размещается кюветыа с пробой;
ж) один или несколько детекторов излучения;
з) регистрирующее устройство.
Идеальным считается источник света, интенсивность излучения которого постоянна во всем диапазоне длин волн. К сожалению, такого источника не существует. Поэтому в приборах, предназначенных для проведения анализов в ультрафиолетовой и видимой области спектра, обычно используют два источника излучения. Первым является дейтериевая лампа, дающая хорошую интенсивность и сплошной спектр излучения в УФ области, вторым - лампа накаливания (галогеновая лампа с вольфрамовой нитью накала) для видимой области.
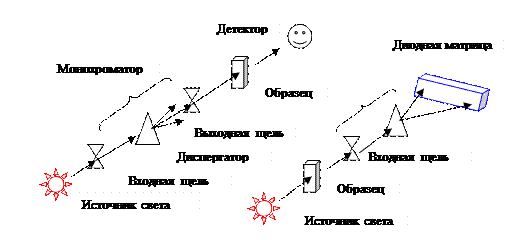
Рис.9.
Монохроматор состоит из входной щели, диспергирующего устройства и выходной щели. Диспергатор обеспечивает рассеивание света с разной длиной волны под различными углами, а выходная щель вырезает узкую спектральную полосу. Чаще всего используются два типа диспергаторов – призмы и дифракционные решетки. Призмы просты и дешевы, но рассеивание света характеризуется нелинейной зависимостью от угла. Дифракционные решетки рассеивают свет с линейной зависимостью от угла и не чувствительны к температуре, но отраженный спектр характеризуется разделением на разные порядки, которые перекрываются. Из-за этого приходится пользоваться фильтрами. В фотоколориметрах диспергатором служит светофильтр, который вырезает из сплошного спектра полосу в необходимом интервале длин волн. За счет увеличения ширины полосыэтого увеличивается поток энергии, падающий на образец, и, как следствие, увеличивается чувствительность прибора.
В качестве детектора применяется фотоэлектронный умножитель (ФЭУ) или фоторезистор. В современных приборах детектором все чаще служит диодная матрица (аналогия с экраном цифрового фотоаппарата), содержащая до 1024 элементов, что дает возможность производить одновременную регистрацию излучения в диапазоне от 190 до 1100 нм с хорошей разрешающей способностью. Вместо монохроматора в этом случае используется полихроматор (входная щель + рассеивающее устройство).
Промышленностью выпускаются разные варианты спектрофотометров: одно- двухлучевые. Каждому варианту конструкции присущи и достоинства и недостатки. Однолучевые – более дешевы, просты в эксплуатации. Простая оптическая схема вносит меньшее ослабление интенсивности света и, следовательно, характеризуется большей чувствительностью. Но измерение контрольного и анализируемого образца производится последовательно. Уход характеристик лампы за этот период может приводить к существенным ошибкам. В 2-хлучевых спектрофотометрах на пути света установлен оптический переключатель, который попеременно направляет луч через канал сравнения и канал образца. За счет этого удается скомпенсировать изменения интенсивности лампы (т.н. уход характеристик лампы) и повысить стабильность. Но в этой схеме используется большее число оптических узлов, что приводит к большей потере интенсивности света и снижению чувствительности.
Большинство обычных спектрофотометров способны обеспечить многоволновые измерения, но требуют механической перестройки для перехода от одной точки спектра к другой, на что затрачивается время. На спектрофотометре с диодной матрицей все точки спектра регистрируются параллельно. Поэтому на многоволновые измерения уходит столько же времени, сколько затрачивается при работе с обычными приборами на измерение на одиночной длине волны. Как правило, конструкция таких приборов менее сложна, количество оптических поверхностей в них меньше, свет проходит с меньшими потерями, и уровень шумов оказывается ниже, хотя разрешающая способность также ниже.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 4665; Нарушение авторских прав?; Мы поможем в написании вашей работы!