
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Факторы, влияющие на скорость химической реакции. Энергия активации, порядок реакции по реагентам и методы их определения
|
|
|
|
МЕТОД ФОНГА
МЕТОД ГУРО
 A P C
A P C
 |
Q R
B
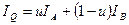 , где
, где 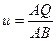 ,
, 
 , где
, где 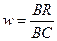 ,
, 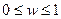
 , где
, где  ,
, 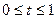
Значение интенсивности можно вычислить инкрементально:


Вычитая одно из другого получим: 
Идентична Гуро, но вначале интерполируется нормаль к поверхности, а потом вычисляется интенсивность
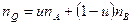 ,
, 
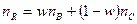 ,
, 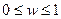
 ,
, 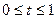

Основными факторами, влияющими на скорость химической реакции, являются температура и концентрация (давление) реагентов, а также наличие растворителя и катализатора (этому посвящены отдельные разделы). При изучении кинетики в реальных, макроскопических системах часто наблюдается зависимость скорости химической реакции от таких физических факторов, как скорость потока, вязкость и теплофизические свойства реакционной смеси, размер частиц реагента и катализатора. Однако эти явления изучает специальная дисциплина – макрокинетика.
Качественной характеристикой зависимости скорости реакции от температуры является температурный коэффициент реакции (предложен Вант-Гоффом), показывающий, во сколько раз возрастает скорость реакции при увеличении температуры на 10 градусов
 (10)
(10)
Величина γ составляет приблизительно 2 - 4 для различных типов реакций. Однако следует помнить, что правило Вант-Гоффа является эмпирическим, и единственной физически обоснованной характеристикой температурной зависимости скорости реакции является энергия активации.
Для вывода этой зависимости используем уравнение изобары химической реакции:
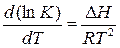 (11)
(11)
где К= k1/k2 – константа равновесия,  - теплота реакции, которую представим, как разность двух величин А, имеющих размерность энергии. Тогда (11) можно записать в виде:
- теплота реакции, которую представим, как разность двух величин А, имеющих размерность энергии. Тогда (11) можно записать в виде:
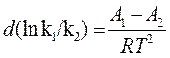 dT (12)
dT (12)
После интегрирования (12) получим

 (13)
(13)
или без индексов: 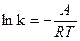 + lnB, откуда
+ lnB, откуда
k = B •exp(-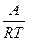 ) (14)
) (14)
где величина А, характеризующая зависимость константы скорости реакции от температуры, названа энергией активации Е и B – предэкспоненциальным множителем или k0.
Сопоставляя (11) и (13) видно, что
E1 – Е2 = ΔН (15)
разность значений энергии активации реакции в прямом и обратном направлении равна тепловому эффекту реакции. Уравнение (15) также отражает связь кинетики реакции с термодинамикой, что проиллюстрировано на рис. 3.
Следует подчеркнуть, что кинетика рассматривает движение реакционной системы через энергетический барьер E, тогда как термодинамика рассматривает только равновесные состояния системы и переход между ними.
     Е
Е1 Е2 Е
Е1 Е2
 Н1 Н1
  Н2 Н2
| Рис. 4. Связь энергии активации и теплоты реакции. Е1 и Е2 энергии активации реакции в прямом и обратном направлении. Н1 и Н2 теплоты образования исходных веществ и продукта |
| Координата реакции |
Обычно влияние температуры на скорость химической реакции проявляется сильнее, чем концентрация реагентов, поскольку показатель экспоненты 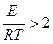 . Сильная зависимость скорости реакции от температуры приводит к тому, что при низких температурах обычно реализуются процессы с низкой энергией активации (например, гидрирование, полимеризация, алкилирование, гидратация); и, наоборот, при высоких температурах реализуются процессы с повышенной энергией активации (например, дегидрирование, деструкция, крекинг, дегидратация) (почему?). Следует отметить, что с повышением температуры возрастает вероятность диффузионного ограничения скорости реакции: диффузия «не успевает» за реакцией, так как температурный коэффициент диффузии (D~T0,5) существенно меньше, чем у реакции.
. Сильная зависимость скорости реакции от температуры приводит к тому, что при низких температурах обычно реализуются процессы с низкой энергией активации (например, гидрирование, полимеризация, алкилирование, гидратация); и, наоборот, при высоких температурах реализуются процессы с повышенной энергией активации (например, дегидрирование, деструкция, крекинг, дегидратация) (почему?). Следует отметить, что с повышением температуры возрастает вероятность диффузионного ограничения скорости реакции: диффузия «не успевает» за реакцией, так как температурный коэффициент диффузии (D~T0,5) существенно меньше, чем у реакции.
Значение энергии активации определяют по найденной экспериментально зависимости логарифма константы скорости от обратной температуры (lnk – 1/T). В этих координатах тангенс угла наклона прямой численно равен отношению 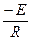 . К сожалению, для определения констант скорости (прямая задача кинетики) необходимо провести кинетический анализ имеющейся информации на основе предполагаемого или известного механизма реакции. Ясно, что эта задача решается далеко непросто.
. К сожалению, для определения констант скорости (прямая задача кинетики) необходимо провести кинетический анализ имеющейся информации на основе предполагаемого или известного механизма реакции. Ясно, что эта задача решается далеко непросто.
Поэтому для нахождения энергии активации на практике поступают следующим образом. Из температурной зависимости начальной скорости реакции, в координатах « » определяют так называемую наблюдаемую энергию активации, Ен. Нетрудно заметить, что в случае, когда кинетическое уравнение имеет вид (1.16), F(Ci) ¹ F(Т) и Ен ≡ Е.
» определяют так называемую наблюдаемую энергию активации, Ен. Нетрудно заметить, что в случае, когда кинетическое уравнение имеет вид (1.16), F(Ci) ¹ F(Т) и Ен ≡ Е.
 ln k; (ln r0) ln k; (ln r0)
 
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 541; Нарушение авторских прав?; Мы поможем в написании вашей работы!
 j
j --------
--------