
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Нернста
|
|
|
|
При условиях отличающихся от стандартных, численное значение равновесного электродного потенциала для окислительно-восстановительной системы, записанной в форме:
Ox + ne– «Red,
где Ox - окисленная форма вещества, а Red - его восстановленная форма, определяется по уравнению Нернста:
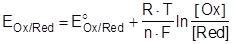
| (3). |
где EOx/Red и E°Ox/Red - соответственно электродный и стандартный электродный потенциалы системы; R - универсальная газовая постоянная; T - абсолютная температура; F - постоянная Фарадея; n - число электронов, участвующих в элементарном окислительно-восстановительном процессе (т.е. стехиометрический коэффициент, стоящий перед электронами в уравнении электрохимической реакции); [Ox] и [Red] - молярные концентрации соответственно окисленной и восстановленной форм соединения.
þ Индекс Ox от англ. oxidizer - окисилитель, индекс Red от англ. reducer - восстановитель
Уравнение Нернста названо в честь его открывателя - немецкого электрохимика, лауреата Нобелевской премии по химии, Вальтера Нернста.
Для удобства расчетов в уравнение Нернста можно подставить значения постоянных (R = 8,314 кДж/(моль.К) и F = 96494 Кл/моль) и перейти от натуральных логарифмов к десятичным (умножая на 2.3). Тогда, при температуре 298К уравнение Нернста примет вид:
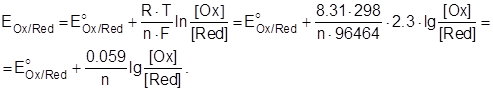
Рассмотрим приложение уравнения Нернста для двух практически важных электродов - металлического и водородного.
1) В случае металлического электрода, представляющего собой пластину соответствующего металла, погруженную в раствор соли данного металла, будет протекать следующая реакция:
Men+ + ne– = Me.
При этом окисленной формой будут являться ионы металла: [Ox]=[Men+], а восстановленной формой - сам металл: [Red]=[Me]. Поскольку концентрация металла как твердого вещества, является константой, электродный потенциал будет определяться только концентрацией ионов металла, и уравнение Нернста имеет вид:
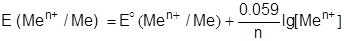
| (4). |
2) В случае водородного электрода, где протекает следующая реакция:
2H+ + 2e- = H2,
окисленной формой являются ионы водорода: [Ox]=[H+], а восстановленной формой - газообразный водород: [Red]=[H2]. Так как газообразный водород непрерывно удаляется из зоны реакции, электродный потенциал определяется только концентрацией ионов водорода H+:
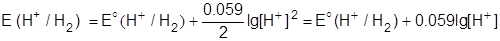 .
.
Поскольку стандартный потенциал водородного электрода равен нулю (E°(H+/H2)=0В) и учитывая, что pH = -lg[H+], получаем:
| E(H+/H2) = -0.059pH | (5). |
Формула (5) позволяет определять потенциал водородного электрода при различных значениях pH. Так, в нейтральной среде (рН = 7) E(H+/H2) = -0,059.7» -0,41В.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1541; Нарушение авторских прав?; Мы поможем в написании вашей работы!