
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства белков
|
|
|
|
Классификация белков
Белки делятся на две основные группы: протеины (простые белки) и протеиды (сложные белки). Протеины состоят только из аминокислот и при гидролизе не образуют других продуктов. Протеиды состоят из белковой части, построенной из α-аминокислот, и из небелковой части (простетической группы). При гидролизе эти белки, кроме α-аминокислот, поставляют и другие вещества: углеводы, фосфорную кислоту, гетероциклические соединения, красящие вещества и т.п.
К протеинам относится ряд простых белков, отличающихся растворимостью в разных растворителях.
Альбумины – белки, растворимые в воде, не осаждаются насыщенным раствором хлорида натрия, но осаждаются насыщенным раствором сульфата аммония, свёртываются при нагревании. Представители: альбумины яйца, молока, сыворотки крови, белки ферментов и семян растений.
Глобулины – белки, нерастворимые в воде, но растворимые в разбавленных солевых растворах; свёртываются при нагревании. Имеют большую молекулярную массу, чем альбумины. Представители: глобулины молока, яйца, крови, белка мышц (миозин), семян растений.
Проламины – белки, растворимые в 70–80%-ном спирте, нерастворимые в воде и безводном спирте. Не свёртываются при кипячении. Представители: белки злаков (глиадин – в пшенице, зеин – в кукурузе).
Глютелины – растительные белки, нерастворимые в нейтральных солевых растворах и в этиловом спирте; растворяются только в разбавленных (0,2%) растворах щелочей. Содержатся, главным образом, в семенах злаков. Глютелины некоторых злаков называют глютенинами (от слова клейковина).
Гистоны – белки основного характера, так как содержат значительное количество диаминокислот, растворимые в воде и в разбавленных кислотах, но нерастворимые в разбавленных щелочах. Обычно представляют белковые части сложных белков. Представители: глобин – белок, входящий в состав гемоглобина.
Протамины – наиболее простые из природных белков с низкими молекулярными массами; состоят преимущественно из диаминокислот и являются сильными основаниями. Хорошо растворимы в воде, в разбавленных кислотах и щелочах. Не свёртываются при нагревании. Представители протаминов обнаружены в сперматозоидах рыб, в составе сложных белков – нуклеопротеидов.
Альбуминоиды (склеропротеины) – белки, резко отличающиеся от других белков по свойствам. Они растворяются лишь при длительной обработке концентрированными кислотами и щелочами с расщеплением молекул. В животных организмах выполняют опорные и покровные функции, в растениях не встречаются. Представителями склеропротеинов являются: фиброин – белок шёлка; кератин – белок волос, шерсти, рогового вещества, эпидермиса кожи; эластин – белок стенок кровеносных сосудов, сухожилий; коллаген – белковое вещество кожи, костей, хрящей, соединительных тканей.
Протеиды – сложные белки, подразделяющиеся на подгруппы в зависимости от характера простетической (небелковой) части.
Фосфопротеиды – белки, содержащие в качестве простетической группы остаток фосфорной кислоты. Представители: казеин – белок молока, вителлин – белок, входящий в состав желтка куриного яйца.
Нуклеопротеиды – белки, в которых собственно белковая часть связана с нуклеиновыми кислотами, а последние при гидролизе образуют фосфорную кислоту, гетероциклические соединения и углевод. Нуклеопротеиды входят в состав ядер растительных и животных клеток.
Хромопротеиды – вещества, в которых белковая часть соединена с красящим веществом. Представитель: гемоглобин крови, при гидролизе он расщепляется, образуя белок глобин и красящее вещество – гем.
Глюкопротеиды – белки, у которых белковая часть соединена с углеводом. Представитель: муцин, входящий в состав слюны.
Липопротеиды – соединения белков с липидами; к последним относятся жиры, фосфатиды и др. Липопротеиды содержатся в протоплазме клеток, в сыворотке крови, в яичном желтке.
Белковые вещества классифицируют также по форме их молекул, подразделяя на две группы:
а) фибриллярные (волокнистые) белки, молекулы которых имеют нитевидную форму; к ним относятся фиброин шёлка, кератин шерсти, миозин мышц;
б) глобулярные белки, молекулы которых имеют округлую форму; к ним относятся альбумины, глобулины и ряд сложных белков.
Пищевая ценность белков обусловлена качественным и количественным составом входящих в них аминокислот. Различают полноценные и неполноценные белки.
Полноценные белки содержат все незаменимые аминокислоты (казеин молока, яичный альбумин, белок мяса).
Неполноценными называют белки, которые не содержат хотя бы одну из незаменимых аминокислот (козеин кукурузы, желатин).
Белковые вещества разнообразны по своему агрегатному состоянию. Часто это твёрдые аморфные вещества, имеющие вид белых порошков. Белки шерсти (кератин) и шёлка (фиброин) – прочные волокна. Некоторые белки получены в кристаллическом состоянии (гемоглобин крови), многие имеют консистенцию вязких жидкостей или студней.
Все белки не растворяются в безводном спирте и других органических растворителях. Многие белки растворяются в воде и в разбавленных растворах солей, но образуют не истинные, а коллоидные растворы. Существуют белки, совершенно нерастворимые в воде.
Растворы природных белков оптически активны (в основном обладают левым вращением).
Белки, подобно аминокислотам, амфотерны и образуют соли как с кислотами, так и с основаниями:
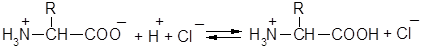
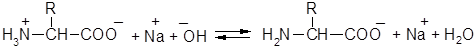
В присутствии кислот белковые молекулы несут положительный заряд и при электролизе передвигаются к катоду, в присутствии щелочей белковые молекулы несут отрицательный заряд и передвигаются к аноду. При определённом значении рН в растворе будет содержаться минимальное количество катионов и анионов белка; в этих условиях передвижение молекул белка при электрофорезе не происходит. Значение рН раствора, при котором в растворе белка содержится минимальное количество катионов и анионов, называется изоэлектрической точкой. Для различных белков значение изоэлектрической точки неодинаково. Например, для яичного белка (альбумина) изоэлектрическая точка находится при рН=4,8, для белка пшеницы (глиадина) – при рН=9,8.
Для всех белков характерны некоторые общие свойства: реакции осаждения из растворов и цветные реакции.
· Осаждение белков из растворов
При добавлении к водным растворам белков концентрированных растворов минеральных солей (например, (NH4)2SO4) белки осаждаются, аналогично действует на белок спирт, ацетон. Во всех этих случаях белки не изменяют своих свойств и при разбавлении водой вновь переходят в раствор. Этот процесс называется высаливанием.
При нагревании многие белки свёртываются (например, яичный белок) и тоже осаждаются из растворов, но теряют способность растворяться в воде. При этом происходит значительное изменение свойств белков. Этот процесс необратимого осаждения белков называется денатурацией. Денатурацию могут вызывать соли тяжёлых металлов (CuSO4, Pb[CH3COO]2, HgCl и др.), концентрированные кислоты (HNO3, H2SO4, CH3COOH, пикриновая, хлоруксусная), едкие щёлочи (КОН, NaOH), фенол, формалин, таннин и др.
Денатурацию белка вызывают также различные виды излучений (ультрафиолетовое, радиоактивное и т.п.). При денатурации разрушается четвертичная, третичная, вторичная структуры; первичная структура при этом обычно сохраняется, то есть разрушение пептидных связей не происходит. Первичная структура белка разрушается при гидролизе белка, что и происходит в процессе усвоения белковой пищи. В желудочно-кишечном тракте под действием ферментов белки пищи расщепляются через ряд промежуточных продуктов до аминокислот. Из комбинации полученных аминокислот в организме создаются необходимые ему белки. Неиспользованные остатки белков подвергаются разрушению до более простых соединений и выводятся из организма.
· Цветные реакции белков
1. Биуретовая реакция
При взаимодействии с солями меди (CuSO4) в щелочной среде все белки дают фиолетовое окрашивание. Эта реакция является качественной на пептидные связи и подтверждает наличие их в белках и полипептидах. Для различных полипептидов окраска, возникающая при взаимодействии с солями меди, неодинакова: дипептиды дают синюю окраску, трипептиды – фиолетовую, а более сложные полипептиды – красную.
2. Ксантопротеиновая реакция.
При нагревании растворов белков с концентрированной азотной кислотой (HNO3) они окрашиваются в жёлтый цвет. Реакция объясняется наличием в белках аминокислот, содержащих ароматические углеводородные радикалы (С6Н5–), которые при взаимодействии с азотной кислотой образуют нитросоединения, окрашенные в жёлтый цвет.
3. Цистиновая реакция (сульфгидрилъная).
Если прокипятить раствор белка с избытком едкого натра и прибавить несколько капель раствора ацетата свинца Рb(СН3СОО)2, то появляется буро-чёрное окрашивание или осадок.
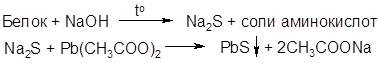
Реакция подтверждает наличие слабо связанной серы в белках.
Имеется и ряд других качественных реакций на белок.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 524; Нарушение авторских прав?; Мы поможем в написании вашей работы!