
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекции 1 и 2
|
|
|
|
Порядок разработки фирменного стиля
1. Разработка концепции имиджа, на которой основан фирменный стиль.
2. Выбор профессионального исполнителя (рекламное агентство, дизайнер и т д.).
3. Проведение патентной экспертизы «на чистоту» названия фирмы.
4. Информационное обеспечение исполнителя, содержащее: полное и точное название фирмы (предприятия) и ее реквизиты на всех требуемых языках, род деятельности фирмы, печатный экземпляр концепции имиджа, перечень стран, с какими фирма сотрудничает, либо будет сотрудничать, полный перечень средств массовой информации, с которыми фирма будет сотрудничать, и рекламных средств, которые она планирует использовать.
Определение катализа. Катализ – фактор научно-технического прогресса в химии и химической технологии. Взаимосвязь ресурсосбережения и экономической эффективности химико-технологических процессов. Роль каталитических эффектов в повышении уровня ресурсосбережения и экологической безопасности
Катализ – ускорение химических реакций под действием особых веществ-катализаторов, которые вступают во взаимодействие с реагентами, активируя их, а к моменту образования продуктов реакции, регенерируются в исходную форму.
Как известно, показатель скорости определяется константой скорости химической реакции, выражаемой уравнением Аррениуса

| (1) |
в котором энергия активации ЕА представляет собой количественное выражение энергетического фактора, а предэкспоненциальный множитель
А – энтропийного фактора.
Путь некаталитической реакции от реагентов до продуктов может быть представлен энергетической диаграммой

Как правило, каталитический эффект заключается в переходе реакции в более выгодное энергетическое русло 2, которое характеризуется меньшими энергетическими барьерами по сравнению с некаталитической реакцией. Такие барьеры реагирующей системы легче преодолеть в соответствие с уравнением (1).
Очевидно, что скорость химической реакции является показателем производительности химической аппаратуры. Об этом свидетельствует даже ее размерность  . Если количество вещества (например продукта) выражается в молях или килограмммах, то из приведенных размерностей следует, сколько вещества снимается в единицу времени с единицы реакционного объема. Тогда производительность процесса может быть выражена как произведение скорости реакции на суммарный объем химических реакторов, обслуживающих данную установку
. Если количество вещества (например продукта) выражается в молях или килограмммах, то из приведенных размерностей следует, сколько вещества снимается в единицу времени с единицы реакционного объема. Тогда производительность процесса может быть выражена как произведение скорости реакции на суммарный объем химических реакторов, обслуживающих данную установку

| (2) |
Очевидно, что увеличивая скорость реакции за счет катализа, можно при заданной производительности снизить объем реакционной аппаратуры и соответственно капитальные затраты.
К такому же выводу можно придти, рассматривая работу проточных трубчатых реакторов. Рассмотрим в этой связи необратимую реакцию
А ® В
первого порядка, скорость которой можно выразить уравнением
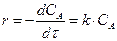
Разделяя переменные, имеем
| –dCA = kdτ | (3) |
Интегрируя последнее уравнение в соответствующих пределах

имеем

где τ – время контакта, определяемое для трубчатого реактора
как 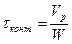 , где V – объем реактора, W – объемная скорость.
, где V – объем реактора, W – объемная скорость.
Анализ последнего выражения и уравнения (3) показывает, что увеличение константы скорости k (катализ!) приводит к снижению tконт. при заданном соотношении 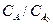 , а следовательно объема реактора.
, а следовательно объема реактора.
Экономия объема реакционной аппаратуры вносит заметный вклад в экономию капитальных затрат, делает установку более компактной, что облегчает задачу управления процессом. Экономия размера реакционной аппаратуры – это экономия металла, что опосредственно влияет на экологическую безопасность окружающей среды, т.к. производство металлов представляет собой экологически наиболее грязные горнорудные производства, последующую переработку руд в металлы, характеризующиеся высокой степенью энергоемкости, значительными выбросами в атмосферу углекислого газа, оксидов серы и азота, которые относятся к глобальным загрязнителям окружающей среды.
С другой стороны, сам факт повышения производительности означает поступление на рынок большого количества продукции. При этом, получаемая прибыль D определяется выражением
| Д = П (Ц – С) | (4) |
где Ц – отпускная цена продукта, С – его себестоимость.
Очевидно, что с ростом скорости реакции r и соответственно производительности П общая прибыль, получаемая предприятием возрастает и производитель может снизить цену, чтобы ускорить реализацию своей продукции на рынке. В этом случае он быстрее получит ожидаемый доход и инвестирует его в соответствующие статьи производства (применение более совершенной технологии, повышение зарплаты как фактора привлечения квалифицированной рабочей силы, вложения в развитие новых инженерных решений на производстве и т.д.). Следует также иметь в виду, что высокопроизводительные производства располагают большими возможностями для снижения себестоимости продукции, что является дополнительным фактором увеличения прибыли.
Катализ обеспечивает более мягкие условия процессов, что приводит к дополнительным возможностям в части ресурсосбережения и экологической безопасности.
Рассмотрим это на примере сравнения каталитической и некаталитической реакций получения одного и того же продукта. Положим, что скорость первой в соответствие с уравнением Аррениуса выражается как

| (5) |
а скорость второй - как

| (6) |
Если предположить, что Acat=Ancat=108, а значение Ecat и Encat составляют соответственно 68 и 148 кДж/моль, то при 5000С (773 К) константа скорости некаталитической реакции составит
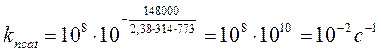
Определим температуру, при которой такую константу скорости обеспечивает каталитическая реакция

Тогда
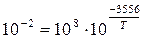
откуда

или

В шкале Цельсия температура составит 355,6 – 273»830С.
Можно видеть, что переход на каталитическую реакцию позволяет снизить температуру с 5000С до 830С.
Итак, благодаря существенному снижению температуры при переходе к каталитическим процессам удается заметно снизить энергетические затраты на поддержание необходимой температуры. С другой стороны, понижение температуры процессов позволяет во многих случаях снизить энергетические затраты на поддержание более высоких давлений. В качестве примера приведем процесс синтеза аммиака
N2 + 3H2  2NH3 + Q 2NH3 + Q
| (7) |
В силу экзотермичности этого процесса равновесие синтеза смещается в правую сторону при понижении температуры и отпадает необходимость повышения давления процесса как дополнительного фактора смещения равновесия в сторону целевого продукта (аммиака). Аналогичная ситуация возникает и при синтезе метанола
СО + 2H2  СH3ОН + Q СH3ОН + Q
| (8) |
Снижение температуры часто является фактором увеличения селевтивности процессов. Это обусловлено неравенством
| Епоб.> Еосн. | (9) |
поскольку большинство побочных реакций – это реакции деструкции, уплотнения и др., которые сопровождаются разрывом прочных химических связей. Такие реакции требуют продолжения больших энергетических барьеров, что и находит свое выражение в неравенстве (9). Справедливость вышеприведенного утверждения можно проиллюстрировать следующими рассуждениями.
Запишем выражение для констант скорости основной и побочной реакций
 
| (10) |
 
| (11) |
Прологарифмируем эти выражения
 
| (12) |
 
| (13) |
Представим эти выражения графически в виде зависимостей логарифмов констант скорости от величины, обратной абсолютной температуре.
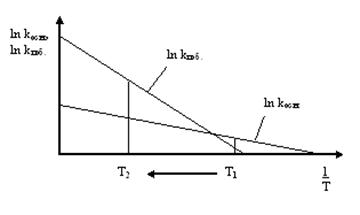
Поскольку Епоб. > Еосн., тангенс угла наклона, соответствующий побочной реакции, 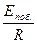 , будет больше, чем тангенс угла наклона основной реакции
, будет больше, чем тангенс угла наклона основной реакции  . Тогда можно видеть, что в области высоких температур (Т2) будет доминировать побочная реакция, а в области низких (Т1) – основная, а это и соответствует увеличению селективности.
. Тогда можно видеть, что в области высоких температур (Т2) будет доминировать побочная реакция, а в области низких (Т1) – основная, а это и соответствует увеличению селективности.
Наконец, природа самих катализаторов, энергетическое состояние их реакционных центров, структурные и текстурные свойства являются факторами селективности. Например, если активные центры гетерогенных катализаторов имеют геометрическое соответствие со структурой сорбирующегося реагента, ответственного за основную реакцию, то это приведет к его избирательной сорбции на этих центрах и доминированию основной реакции.
Так, в процессе селективного гидрирования примесей алкинов и алкадиенов в этилене показано, что большинство побочных реакций, сопровождающих этот процесс. протекают через активные центры большей мультиплетности, чем основная реакция. Чтобы увеличить селективность необходимо подавить количество мультиплетных ансамблей. Этот результат можно получить путем применения сплавных двухкомпонентных катализаторов, например Pd–Sn. В этой системе Pd является активным металлом, а олово – действует как инертный разбавитель. Увеличивая долю разбавителя можно уменьшить число мультиплетных ансамблей, ответственных за побочные реакции и увеличить селективность процесса. На примере того же процесса на катализаторе Pd–Ag можно проиллюстрировать действие энергетического фактора на селективность. Известно, металлическое серебро действует как донор электронов по отношению к палладию. Благодаря этому адсорбция этилена и ацетилена на поверхности ухудшается, причем адсорбционная способность этилена снижается в большей степени, чем ацетилена. Поэтому последний сорбируется и затем гидрируется более предпочтительно. Наоборот, образующийся этилен легко десорбируется с поверхности, вытесняясь новыми порциями ацетилена. Таким образом, благодаря более предпочтительной сорбции ацетилена на поверхности и более легкой десорбции этилена с поверхности, вторичные реакции с его участием подавляются и селективность по этилену возрастает.
Еще более показательные примеры увеличения селективности связаны с молекулярно-ситовым катализом на цеолитах. Специфическая селективность цеолитов связана с наличием в них пор определенного размера, через которые в зерно катализатора могут проникать только молекулы определенного размера или только часть продуктов может из них диффундировать обратно. Благодаря этому эффекту удалось существенно (до 92%) увеличить выход п-дихлорбензола в процессе хлорирования хлорбензола

при степени превращения исходного хлорбензола 70%, используя в качестве катализаторов цеолиты K–L и Na–L, пропитанные галогенидами, нитратами, карбонатами или сульфатами щелочных, щелочно-земельных металлов и лантана.
Следует подчеркнуть, что селективность является показателем ресурсосберегающего характера химических процессов. Более высокая селективность означает, что бóльшая часть сырья использована на образование полезных продуктов.
Другим важным ресурсосберегающим показателем химических процессов является степень конверсии. Очевидно, что чем больше степень конверсии, тем меньше осталось непрореагировавшего сырья и тем меньше будут затраты на рецикл, т.е. извлечение этого остаточного сырья из выходящего реакционного потока и возвращения его в новый цикл превращений. Катализ, обеспечивая высокие скорости процесса, позволяет достичь необходимых конверсий или даже увеличить их. С другой стороны, катализ позволяет достичь более высоких конверсий косвенным путем в случае реализации обратимых экзотермических реакций. Подобный эффект был достигнут в промышленном синтезе аммиака и металла при переходе на низкотемпературные катализаторы.
Таким образом, переход на каталитические методы – основа разработки новых и совершенствование существующих химических производств, характеризующихся более мягкими условиями процессов, более высокими выходами целевых продуктов и степенями конверсии реагентов по сравнению с существующими аналогами. Обеспечение за счет этого более высоких показателей по энергосбережению, экономии сырья и длительности эксплуатации химических установок. Мягкие условия процессов являются также фактором перехода на более дешевые конструкционные материалы.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 300; Нарушение авторских прав?; Мы поможем в написании вашей работы!