
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамические потенциалы. Максимальная полезная работа
|
|
|
|
Второй закон термодинамики позволяет установить направленность процессов в термодинамической системе, однако по изменению термодинамических функций ∆U и ∆ S нельзя оценить величину производимой работы. Максимальная полезная работа δАmax, сопровождающая всевозможные химические превращения, связана с другими термодинамическими функциями состояния системы:
свободной энергии
 (1.10)
(1.10)
и полного термодинамического потенциала
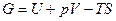 , (1.11)
, (1.11)
которые вводятся на основании первого и второго законов и зависят от переменных F=F(T,V), G=G(T,p) соответственно. Если процессы осуществляются при постоянных температуре (Т = const) и объеме (V = const), то максимальная полезная работа в системе выполняется за счет изменения свободной энергии Гелъмголъца (F - изохорно-изотермический потенциал). В этом случае pdV=0 и
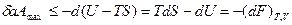 (1.12)
(1.12)
Если Т = const и p=const, то максимальная полезная работа производится за счет изменения свободной энергии Гиббса (G - изобарно-изотермический потенциал):
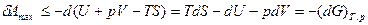 , (1.13)
, (1.13)
Где знак “ < ” соответствует необратимым процессам.
Таким образом, по величине и знаку изменения термодинамического потенциала можно судить о направленности процессов. Если в результате определенных процессов термодинамические потенциалы понижаются (dF < 0 или dG < 0), такие процессы являются самопроизвольными. Они происходят с выделением энергии и называются экзергоническими. Процессы, которые идут с увеличением термодинамических потенциалов (dF > 0 или dG > 0), не являются самопроизвольными и сопровождаются поглощением дополнительной энергии из внешней среды. Такие процессы называют эндергоническими.
При достижении равновесия в системе термодинамические потенциалы стремятся к минимальным значениям
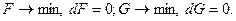
В биологических системах процессы обычно происходят при р = const, поэтому в термодинамических оценках преимущественно используется потенциал G.
Состояние системы является функцией числа молей ni составляющих ее веществ. При этом следует помнить, что в закрытой системе при протекании химических реакций все ni - независимые переменные. Изменение химической энергии системы пропорционально изменению числа молей соответствующих компонентов системы dni. Обычно этот коэффициент пропорциональности обозначают μi и называют его химическим потенциалом. Химический потенциал представляет собой изменение любой термодинамической функции U,H,F,G, отнесенное к изменению количества молей
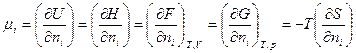 (1.14)
(1.14)
С помощью химического потенциала изменение внутренней энергии системы в зависимости от изменения ее состава определяется уравнением Гиббса:
 (1.15)
(1.15)
Таким образом, на основании второго закона термодинамики можно вычислять изменения свободной энергии F или полного термодинамического потенциала G, которые сопровождают биохимические превращения в живых системах. Кроме того, подходы равновесной термодинамики могут быть использованы при решении вопросов, связанных с переносом заряженных и нейтральных веществ через клеточные мембраны. Различные способы расчетов изменения свободной энергии достаточно полно освещены в курсах биохимии; их рассмотрение выходит за рамки настоящего пособия. Все они основаны на обычных представлениях классической термодинамики, согласно которым полное изменение свободной энергии в системе сопоставляют с достижением равновесного конечного состояния в соответствующей биохимической реакции. При этом не учитывается характер самого изменения свободной энергии во времени.
|
|
|
Дата добавления: 2014-01-07; Просмотров: 809; Нарушение авторских прав?; Мы поможем в написании вашей работы!