
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второй закон термодинамики. Этот закон устанавливает критерий, отражающий одностороннюю направленность необратимых процессов независимо от их конкретной природы
|
|
|
|
Этот закон устанавливает критерий, отражающий одностороннюю направленность необратимых процессов независимо от их конкретной природы. Согласно второму закону, состояние термодинамической системы может быть описано особой функцией состояния - энтропией S. Изменение энтропии dS определяется суммарным значением поглощенных системой приведенных теплот Q/T. При бесконечно малом изменении состояния системы изменение энтропии dS равно (если процесс равновесный) или больше (если процесс неравновесный) значения поглощенной системой элементарной приведенной теплоты δQ/T
 (1.8)
(1.8)
Для системы, которая не обменивается теплом с внешней средой, δQ=0 и уравнение (1.8) принимает вид
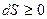 (1.9)
(1.9)
Следовательно, в изолированной системе энтропия остается неизменной в равновесных процессах и возрастает в неравновесных. Это и является критерием направленности превращений в изолированной системе. Таким образом, протекающий в изолированной системе самопроизвольный неравновесный процесс всегда вызывает увеличение энтропии до ее максимальных значений при окончании процесса и установлении термодинамического равновесия. Энтропия измеряется в Дж/К или в энтропийных еденицах (э.ед).
В качестве примера приведем абсолютные значения энтропии 1 М воды (Н2О) в различных агрегатных состояниях:
- в твердом состоянии (лед): S = 41кДж/К (9,8э.ед);
- в жидком состоянии: S = 70кДж/К (16,7э.ед);
- в газообразном состоянии (при давлении 1 атм): S = 189кДж/К (45,1э.ед).
Приведенные данные хорошо показывают корреляцию энтропии с неупорядоченностью системы: чем более неупорядоченная система (газообразное состояние), тем больше ее энтропия. Это обстоятельство не является случайным и находит свое объяснение при трактовке энтропии с помощью понятий статистической физики, данной впервые Л. Больцманом. Энтропия, согласно трактовке Больцмана, является мерой неупорядоченности системы. В результате самопроизвольных процессов изолированная система переходит в состояние термодинамического равновесия, которое характеризуется максимальной энтропией (рис.1).

Рис. 1. Изменение энтропии S изолированной системы при достижении состояния термодинамического равновесия.
При равновесии происходят флуктуации, вызывающие локальное уменьшение энтропии dS < 0. Но в системе возникают такие процессы, которые возвращают ее назад в равновесное состояние с максимальной энтропией и максимальной разупо-рядоченностью. Следовательно, стремление энтропии к максимальному значению является главным эволюционным принципом изолированной термодинамической системы.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 300; Нарушение авторских прав?; Мы поможем в написании вашей работы!