
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Выпарные установки
|
|
|
|
При кипении растворов нелетучих веществ (например, растворов солей, щелочей, органических веществ с очень низким давлением паров при температуре кипения и т.п.) в пары переходит практически только растворитель. По мере его испарения и удаления в виде паров концентрация раствора повышается.
Парообразование – это Переход вещества из жидкого или твердого состояния в газообразное называется парообразованием. Различают следующие виды парообразования: испарение и кипение.
Парообразование со свободной поверхности жидкости называется испарением, с поверхности твердого тела - сублимацией или возгонкой.
Вследствие теплового движения молекул испарение возможно при любой температуре, но с возрастанием температуры скорость испарения увеличивается.
Испарение – Парообразование со свободной поверхности жидкости.
Выпаривание – Процесс концентрирования растворов, заключающийся в частичном удалении растворителя путем его перевода в парообразное состояние испарения при нагревании кипении (иногда при понижении давления), называется выпариванием.
Концентрирование – Процесс выпаривания, применяемый для частичного разделения (концентрирования) растворов.
Кристаллизацией сопровождается п роцесс выпаривания, применяемый для полного выделения твердых веществ из раствора.
Кипение – переход жидкости в парообразное состояние при такой температуре, когда упругость паров жидкости равна давлению окружающего пространства.
Упругостью насыщенных паров капельной жидкости называется такое их парциальное давление, при котором наступает термодинамическое равновесие между паровой и жидкой фазами(или давление насыщенных паров жидкости р [Па]).
Парциальное давление паров- это
Испарение – переход жидкости в парообразное состояние при такой температуре, когда упругость паров жидкости равна давлению окружающего пространства.
Испарение при температурах ниже температуры кипения данного раствора происходит с его поверхности, в то время как при кипении растворитель испаряется во всем объеме кипящего растворителя из раствора.
Обычно из раствора удаляют лишь часть растворителя, так как в применяемых для выпаривания аппаратах вещество должно оставаться в текучем состоянии. В ряде случаев при выпаривании растворов твердых веществ достигается насыщение раствора. При дальнейшем удалении растворителя из такого раствора происходит кристаллизация, т.е. выделение из него твердого вещества.
Процесс выпаривания широко применяется для повышения концентрации разбавленных растворов, выделения из них растворенных веществ путем кристаллизации, а иногда – для выделения растворителя (например, при получении питьевой или технической воды в выпарных опреснительных установках).
Для осуществления процесса выпаривания необходимо теплоту от теплоносителя передать кипящему раствору, что возможно лишь при наличии разности температур между ними. При анализе и расчете процесса выпаривания эту разность температур между теплоносителем и кипящим раствором принято называть полезной разностью температур. В качестве теплоносителя в выпарных аппаратах чаще всего используют насыщенный водяной пар, который называют греющим или первичным, хотя, конечно, для этой цели могут быть применены и другие виды нагрева, и другие теплоносители.
Таким образом, выпаривание является типичным процессом переноса теплоты от более нагретого теплоносителя - греющего пара – к кипящему раствору. Основные отличия процесса выпаривания, вследствие которых выпаривание в ряду тепловых процессов выделяют в самостоятельный раздел, заключаются в особенностях его аппаратурного оформления и методе расчета выпарных установок.
Выпаривание проводят при атмосферном давлении, под вакуумом или под давлением, большим атмосферного. Образующийся при выпаривании растворов пар называется вторичным, или соковым. (экстра-пар – это вторичный пар, который отбирается от выпарной установки и предназначен для использования в нагревательных установках вне данной выпарной установки).
Выпаривание под вакуумом имеет ряд преимуществ по сравнению с атмосферной выпаркой: снижается температура кипения раствора, что дает возможность использовать этот способ для выпаривания растворов термически нестойких веществ; повышается полезная разность температур, что ведет к снижению требуемой поверхности теплопередачи выпарного аппарата; несколько снижаются потери теплоты в окружающую среду (так как снижается температура стенки аппарата); появляется возможность использования теплоносителя низкого потенциала. К недостаткам выпаривания под вакуумом относятся удорожание установки (так как требуется дополнительное оборудование – конденсатор, вакуум–насос и др.), а также несколько больший расход греющего пара на 1 кг выпариваемой жидкости (вследствие снижения давления над раствором происходит увеличение теплоты испарения растворителя – «скрытой теплоты испарения»).
При выпаривании под повышенным давлением (выше атмосферного) вторичный пар может быть использован в качестве греющего агента для различных технологических нужд.
В случае, если в выпарной установке имеется один выпарной аппарат (рис.1.1), такую установку называют однокорпусной. Если же в установке имеются два и более последовательно соединенных корпусов, то такую установку называют многокорпусной. В этом случае вторичный пар одного корпуса используют для нагревания в других выпарных аппаратах той же установки, что приводит к существенной экономии свежего греющего пара. Вторичный пар, отбираемый из выпарной установки для других нужд, называют экстра-паром. В многокорпусной выпарной установке свежий пар подают только в первый корпус. Из первого корпуса образовавшийся вторичный пар поступает во второй корпус этой же установки в качестве греющего, в свою очередь вторичный пар второго корпуса поступает в третий корпус в качестве греющего и т.д.
При больших производительностях (от нескольких кубических метров выпариваемого раствора в час и выше), что характерно для промышленности, выпаривание проводят по непрерывному принципу. В аппаратах непрерывного действия обычно создают условия для интенсивной циркуляции раствора, т.е. в таких аппаратах гидродинамическая структура потоков близка к модели идеального смешения. Поэтому концентрация раствора в таких аппаратах ближе к конечной, что приводит к ухудшению условий теплопередачи (так, с повышением концентрации раствора увеличивается его вязкость и, следовательно, снижается коэффициент теплоотдачи от стенки к раствору).
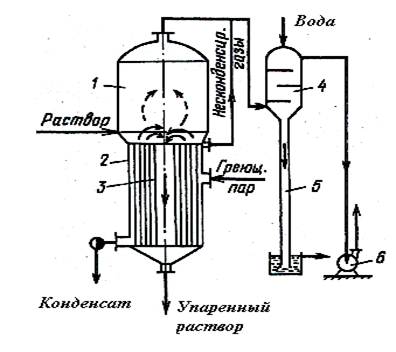
Рис. 1.1. Схема однокорпусной выпарной установки:
1 – сепаратор; 2 – греющая камера; 3 – циркуляционная труба; 4 – барометрический конденсатор; 5 – барометрическая труба; 6 – вакуум-насос
Периодическое выпаривание проводят при малых производительностях и необходимости упаривания раствора до существенно высоких концентраций.
1.1. Свойства растворов [1]
Под концентрацией раствора b понимается отношение массы сухого вещества Gc,, кг, содержащегося в растворе, к общей массе раствора. Она может выражаться в процентах или относительных величинах.
b=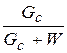 , (1.1)
, (1.1)
где W – количество растворителя в растворе, кг.
Растворителями могут быть вода, спирты, органические жидкости и т.д. В технике чаще всего имеют дело с водными растворами солей.
Для большинства растворов в определенном количестве воды или другого растворителя нельзя растворить неограниченное количество твердого вещества. Раствор, содержащий при данных условиях предельное количество растворенного вещества, называется насыщенным [1].
Количество растворенного вещества в насыщенном растворе, отнесенное к определенному количеству раствора или растворителя, называется растворимостью (табл. 1.1). Растворимость твердых веществ в воде не является постоянной величиной, а изменяется в значительных пределах в зависимости от температуры. Для большинства солей растворимость в воде с повышением температуры растет; для некоторых солей она понижается (CaCrO4, MnSO4, NaSO4 и др.), и избыток соли выпадает в виде кристаллов. У поваренной соли NaCI растворимость от температуры практически не зависит [1].
Присутствие кристаллов в растворе при выпаривании нежелательно, так как они осаждаются на стенках аппарата и поверхностях нагрева кипятильников и образуют слой накипи или осадка, которые снижают теплопередачу и ухудшают работу выпарных аппаратов.
Таблица 1.1. Растворимость некоторых веществ в воде при температуре 20 оС
| Вещество | Растворимость в воде г/100 г H2О | Концентрации насыщенного раствора, % | Вещество | Растворимость в воде г/100 г H2О | Концентрации насыщенного раствора, % |
| NaCI | 35,8 | 26,4 | BaSO4 | 0,00023 | 0,00023 |
| КCI | 34,2 | 25,5 | Mg(OH)2 | 0,001 | 0,001 |
| Na2СO3 | 21,2 | 17,6 | CaCO3 | 0,0014 | 0,0014 |
| NaOН | 107,0 | 51,7 | Ca(OH)2 | 0,16 | 0,16 |
| ВаCI | 35,6 | 26,3 | NaSO4 | 32,8 | 24,7 |
| СаSO4 | 0,2 | 0,2 | MgCI2 | 35,3 | 26,1 |
Процесс выпаривания характерен значительным изменением физико-химических свойств растворов, связанных с изменением его концентрации.
С повышением концентрации увеличиваются плотность и вязкость, понижаются удельная теплоемкость, теплопроводность и интенсивность теплоотдачи, изменяется теплота растворения [1].
Плотность раствора можно легко определить по правилу аддитивности, зная его концентрацию и плотности чистых компонентов при данной температуре:
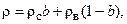 , (1.2)
, (1.2)
где 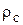 - плотность безводного нелетучего вещества, кг/м3;
- плотность безводного нелетучего вещества, кг/м3; 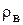 - плотность растворителя (воды), кг/ м3.
- плотность растворителя (воды), кг/ м3.
Все жидкие растворы обладают вязкостью, характерной для данного раствора. Вязкость всех растворов существенно зависит от температуры, уменьшаясь с ее повышением.
Численные значения динамической и кинематической вязкости растворов даются в справочной и специальной литературе. Изменение вязкости в зависимости от концентрации для некоторых растворов приведено
 |
на рис. 1.2.
Рис.1.2. Изменение массовой удельной теплоемкости водных растворов в зависимости от концентрации раствора при 20 оС:
1 – NaOH; 2 – KOH; 3 – (NH4)2SO4; 4 – NaNO2; 5 – NH4NO3; 6 – K2CO3; 7 – CACI2
Удельную теплоемкость раствора с р, кДж/(кг·К), приближенно можно определить также по правилу аддитивности:
с р= с с b + с в(1- b), (1.3)
где с с – удельная теплоемкость безводного нелетучего вещества в растворе (табл. 1.2); с в – удельная теплоемкость воды при 20 оС.
Таблица 1.2. Удельная теплоемкость сухих (безводных) веществ [1]
| Вещество | с сух, кДж/(кг· К) |
| С3Н8О3 | 2.41 |
| С5Н10О5 | 1.29 |
| СаСI2 | 0.687 |
| KCI | 0.676 |
| KNO3 | 0.965 |
| NaCI | 0.837 |
| NaNO3 | 1.089 |
| NH4NO3 | 1.37 |
| (NH4)2SO4 | 1.42 |
| NH4CI | 1.52 |
Удельную теплоемкость химического соединения при отсутствии данных можно ориентировочно рассчитать по уравнению [6]:
 (1.4)
(1.4)
где 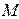 - молекулярная масса химического соединения; с – его массовая удельная теплоемкость, Дж/(кг ·К); п 1, п 2, п 3 … - число атомов элементов, входящих в соединение; с 1, с 2, с 3, … - атомные теплоемкости, Дж/(кг·атом·К), приведенные в табл.1.3.
- молекулярная масса химического соединения; с – его массовая удельная теплоемкость, Дж/(кг ·К); п 1, п 2, п 3 … - число атомов элементов, входящих в соединение; с 1, с 2, с 3, … - атомные теплоемкости, Дж/(кг·атом·К), приведенные в табл.1.3.
Таблица 1.3. Атомная теплоемкость
| Элемент | Атомная теплоемкость | Элемент | Атомная теплоемкость, Дж/ с·кг | ||
| В твердом состоянии | В жидком состоянии | В твердом состоянии | В жидком состоянии | ||
| С | 7,5 | 11,7 | F | 20,95 | 29,3 |
| H | 9,6 | P | 22,6 | ||
| B | 11,3 | 19,7 | S | 22,6 | |
| Si | 15,9 | 24,3 | остальные | 33,5 | |
| O | 16,8 | 25,1 |
Удельные теплоемкости некоторых веществ приведены в табл.1.2. Удельная теплоемкость раствора зависит не только от концентрации растворенного вещества, но и от температуры. Для многих растворов удельная теплоемкость не подчиняется правилу аддитивности и не может быть достаточно точно вычислена по формуле (1.3). Отклонение от правила аддитивности тем больше, чем больше концентрация растворенного вещества (рис.1.2). Поэтому в точных расчетах целесообразно использовать опытные значения удельной теплоемкости растворов, приводимые в виде таблиц или номограмм.
Теплопроводность растворов 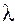 за редким исключением с ростом концентрации растворенного вещества уменьшается (рис. 1.3).
за редким исключением с ростом концентрации растворенного вещества уменьшается (рис. 1.3).
Теплопроводность воды и водных растворов электролитов в интервале от 20 до 100 оС различаются незначительно. Поэтому зависимость теплопроводности водных растворов солей и щелочей от температуры может быть принята такой же, как и для воды:
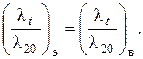 (1.5)
(1.5)
Для воды 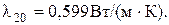
При растворении твердых веществ в воде наблюдается охлаждение раствора, так как разрушается кристаллическая решетка, а на это требуется затрата энергии. Теплота растворения зависит от природы вещества и растворителя, а также от концентрации раствора.
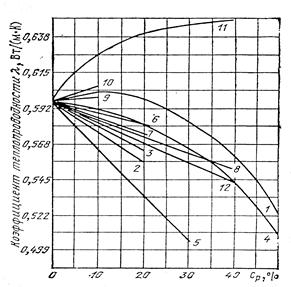
Рис.1.3. Изменение теплопроводности водных растворов солей в зависимости от концентрации раствора при 20 оС:
1 – КОН; 2 – КСI; 3 – КNО3; 4 – К2СО3; 5 – MgCI2; 6 – MgSO4; 7 – NaCI; 8 – NaNO3; 9 – NaSO4; 10 – Na2CO3; 11 – NaOH; 12 – CaCI2
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 4207; Нарушение авторских прав?; Мы поможем в написании вашей работы!