
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физико-химические свойства углеводородных газов
|
|
|
|
Нефтяной газ при нормальных условиях – неполярная, аддитивная система (смесь компонентов от С1 до С4). Следовательно, к нему при нормальных условиях применимы аддитивные методы расчётов физико-химических и технологических параметров (Псмеси):
 , (3.3)
, (3.3)
где gi – весовая доля;
Ni – мольная доля;
Vi – объёмная доля;
Пi – параметр i-го компонента.
Плотность смеси газов рассчитывается следующим образом:
 . (3.4)
. (3.4)
При нормальных условиях плотность газа rг = Mi / 22,414.
Нефтяной газ представлен в виде смеси углеводородов, поэтому для оценки его физико-химических свойств необходимо знать, как выражается состав смеси.
Массовая доля (gi) – отношение массы i-го компонента, содержащегося в системе к общей массе системы:
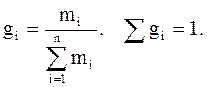 (3.5)
(3.5)
Молярная (мольная) доля (Ni) – отношение числа молей i-го компонента к общему числу молей в системе:
 (3.6)
(3.6)
 , (3.7)
, (3.7)
где mi – масса i-го компонента;
Мi – молекулярный вес.
 (3.8)
(3.8)
Объёмная доля (Vi) – доля, которую занимает компонент в объёме системы.
 (3.9)
(3.9)
Для идеального газа соблюдается соотношение Vi = Ni.
Молекулярная масса смеси рассчитывается следующим образом:
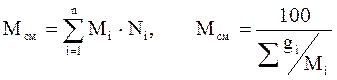 (3.10)
(3.10)
Относительная плотность газа по воздуху:
 . (3.11)
. (3.11)
Для нормальных условий 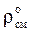 » 1,293; для стандартных условий
» 1,293; для стандартных условий 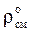 » 1,205.
» 1,205.
Если плотность газа задана при атмосферном давлении (0,1013 МПа), то пересчёт её на другое давление (при той же температуре) для идеального газа производится по формуле:
 . (3.12)
. (3.12)
Смеси идеальных газов характеризуются аддитивностью парциальных давлений и парциальных объёмов.
Для идеальных газов давление смеси равно сумме парциальных давлений компонентов (закон Дальтона):
 , (3.13)
, (3.13)
где Р – давление смеси газов;
рi – парциальное давление i-го компонента в смеси,
или
 . (3.14)
. (3.14)
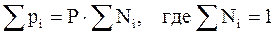 . (3.15)
. (3.15)
Т. е. парциальное давление газа в смеси равно произведению его молярной доли в смеси на общее давление смеси газов.
Аддитивность парциальных объёмов компонентов газовой смеси выражается законом Амага:
 , (3.16)
, (3.16)
где V – объём смеси газов;
Vi – объём i-го компонента в смеси.
или
 . (3.17)
. (3.17)
Для определения многих физических свойств природных газов используется уравнение состояния.
Уравнением состояния называется аналитическая зависимость между параметрами, описывающими изменение состояние вещества. В качестве таких параметров используется давление, температура, объём.
Состояние газа при стандартных условиях характеризуется уравнением состояния Менделеева-Клайперона:
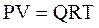 , (3.18)
, (3.18)
где Р – абсолютное давление, Па;
V – объём, м3;
Q – количество вещества, кмоль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная Па×м3/(кмоль×град).
У этого уравнения есть свои граничные условия. Оно справедливо для идеальных газов при нормальном (1 атм.) и близких к нормальному давлениях (10-12 атм.).
При повышенном давлении газ сжимается. За счёт направленности связи С-Н происходит перераспределение электронной плотности, и молекулы газов начинают притягиваться друг к другу.
Для учёта этого взаимодействия в уравнение (3.18) вводится коэффициент сверхсжимаемости z, предложенный голландским физиком Ван-дер-Ваальсом, учитывающий отклонения реального газа от идеального состояния:
 , (3.19)
, (3.19)
где Q – количество вещества, моль.
Физический смысл коэффициента сверхсжимаемости заключается в расширении граничных условий уравнения Клайперона-Менделеева для высоких давлений.
Коэффициент z зависит от давления и температуры, природы газа (критических давлений и температуры).
Критическое давление – давление, при котором газообразный углеводород переходит в жидкое состояние.
Критическая температура – температура, при которой жидкий углеводород переходит в газообразное состояние.
Приведёнными параметрами индивидуальных компонентов называются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа отклоняются от критических:
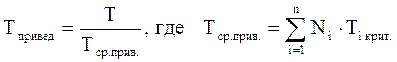 (3.20)
(3.20)
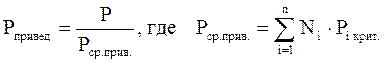 (3.21)
(3.21)
 (3.22)
(3.22)
Существуют графики, эмпирические формулы и зависимости для оценки коэффициента сверхсжимаемости от приведенных давлений и приведенных температур.
Зная коэффициент сверхсжимаемости, можно найти объём газа в пластовых условиях по закону Бойля-Мариотта:
 . (3.23)
. (3.23)
Объёмный коэффициент газа используется при пересчёте объёма газа в нормальных условиях на пластовые условия и наоборот (например, при подсчёте запасов):
 (3.24)
(3.24)
Вязкость газа – свойство газа оказывать сопротивление перемещению одной части газа относительно другой.
Различают динамическую вязкость m и кинематическую вязкость n. Кинематическая вязкость учитывает влияние силы тяжести.
Динамическая вязкость зависит от средней длины пробега молекул газа и от средней скорости движения молекул газа:
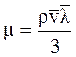 , (3.25)
, (3.25)
где r – плотность газа;
 – средняя длина пробега молекулы;
– средняя длина пробега молекулы;
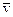 – средняя скорость молекул.
– средняя скорость молекул.
Кинематическая вязкость природного газа при нормальных условиях невелика и не превышает 0,01 сантипуаза.
Динамическая вязкость газа увеличивается с ростом температуры (при повышении температуры увеличивается средняя скорость и длина пробега молекул), однако при давлении более 3 МПа вязкость с ростом температуры начинает снижаться. От давления вязкость газа практически не зависит (снижение скорости и длины пробега молекул при увеличении давления компенсируется ростом плотности).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 390; Нарушение авторских прав?; Мы поможем в написании вашей работы!