
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Гесса
|
|
|
|
Этот закон был открыт Гессом в 1840 г. на основании обобщения множества экспериментальных данных.
Формулировка закона Гесса:
Тепловой эффект реакции, протекающей при постоянном давлении (Qp = DН) или при постоянном объеме (QV = DU) и постоянной температуре, определяется только природой и состоянием исходных веществ и продуктов реакции и не зависит от пути перехода от исходных веществ к продуктам реакции (т.е. реакцию можно проводить в одну, две, три и т.д. стадии).
Закон Гесса основан на том, что Qp и QV – функции состояния (в отличие от Q).
QV = ∆U, V= const,
QP = ∆H, p= const (20)
Рассмотрим процесс перехода от исходных веществ к продуктам реакции при р = const, Т = const. Тогда Qp = DН. Составим так называемый термохимический цикл. Пусть от исходных веществ к продуктам реакции можно перейти тремя различными путями - в одну, две или три стадии:
 |
По закону Гесса DН1 = DН2 + DН3 = DН4 + DН5+ DН6.
Следствия из закона Гесса.
Первое следствие из закона Гесса.
Тепловой эффект реакции равен разности между суммой теплот образования из простых веществ (DfH) продуктов реакции и суммой теплот образования из простых веществ исходных веществ (с учетом стехиометрических коэффициентов).
Математическое выражение для первого следствия из закона Гесса можно записать в следующем виде:
 (21)
(21)
Теплота образования ∆fН - это тепловой эффект реакции образования 1 моль соединения из простых веществ.
Стандартное состояние характеризуется и давлением р = 1 атм = 1·105Па.
Тепловые эффекты, отнесённые к этим условиям, называются стандартными тепловыми эффектами.
Стандартная энтальпия (теплота) образования соединения из простых веществ (DfH0298) – это есть тепловой эффект реакции образования 1 моль данного соединения из соответствующих количеств простых веществ при стандартных условиях.
Простые вещества -это химические элементы или вещества, взятые в тех агрегатных состояниях или кристаллических модификациях, в которых они устойчивы при стандартном состоянии.
Принято, что для простых веществ DfH0298 = 0.
Второе следствие из закона Гесса.
Тепловой эффект реакции равен разности между суммой теплот сгорания (DcH) исходных веществ и суммой теплот сгорания продуктов реакции (с учетом стехиометрических коэффициентов).
Математическое выражение для вторго следствия из закона Гесса можно записать в следующем виде:
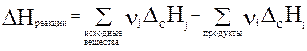 (22)
(22)
Стандартная энтальпия ( теплота) сгорания соединения (обозначаемая как DcH0298) – это есть тепловой эффект реакции окисления 1 моль данного сединения газообразным молекулярным кислородом при стандартном условиях с образованием соответствующих количеств следующих веществ (если не указано иначе): СО2, газ, Н2Ожидк., N2, газ,. Hhal,(Cl,Br), SO2 газ. и др.
Единицы измерения [DfН] и [DсН] равны кДж/моль, [n] = моль, [DНреакции] = кДж!
Пример 1.1 Рассчитать тепловые эффекты двух следующих реакций:
а) 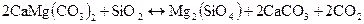 ;
;
б) 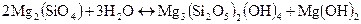 ,
,
если известны стандартные теплоты образования всех компонентов данных реакций.
Решение. Выполним расчеты для 250С и давления 1 атм, приняв условие постоянства давления в ходе реакций. В этом случае тепловой эффект должен быть равен изменению энтальпии системы:
а) 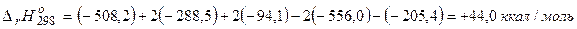 ;
;
б) 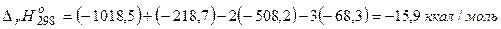 .
.
Пример 1.2 Рассчитать тепловой эффект полиморфного превращения 1 моль графита в алмаз при стандартных условиях, если известны стандартные теплоты сгорания графита и алмаза при Т = 298,15 К и Р = 1атм.
1. 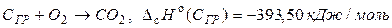 ;
;
2. 
Решение. Запишем реакцию полиморфного превращения графита в алмаз:
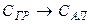 .
.
Расчет показывает, что
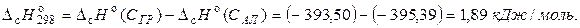
Следовательно, процесс превращения графита в алмаз при стандартных условиях (если бы он имел место) должен был бы происходить с поглощением небольшого количества тепла.
1.7 Связь между Qp и QV для химических реакций.
Рассмотрим реакцию, протекающую при постоянном давлении p. По определению:
Н º U + pV; тогда
DH = DU + pDV
Qp = QV + pDV
Qp – QV = pDV (23)
Если в реакции участвуют газообразные вещества, то, считая их идеальными газами, с учетом уравнения Менделеева-Клапейрона
pDV = DnгазRT, (24)
можно получить выражения:
DH = DU + DnгазRT или Qp = QV + DnгазRT или Qp – QV = DnгазRT,
где Dnгаз – изменение числа молей газообразных веществ в результате одного пробега реакции,
т.е. 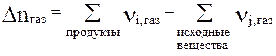 (25)
(25)
Один пробег реакции означает, что в реакцию вступило такое количество молей каждого из веществ, которое соответствует их стехиометрическим коэффициентам в уравнении реакции.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 973; Нарушение авторских прав?; Мы поможем в написании вашей работы!