
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Діелектрична стала
|
|
|
|
Висока розчинна здатність води зумовлена діелектричними властивостями води. Діелектрична стала води D визначається як відношення ємності конденсатора, в якому пластини розділені водою(e) до ємності конденсатора із вакуумом замість ізолятора (eo)
D = e/eo
і складає 78.47. Для порівняння діелектрична стала метану, типової неполярної молекули, рівняється 1,7. Висока D знижує притягнення між іонами.
 |
Згідно закону Кулона сила притягання між зарядами обернено пропорційна добутку діелектричної сталої і квадрату відстані між зарядами.
Полярні молекули води оточують заряджений іон, ізолюючи його від впливу електричних полів інших іонів. Ця властивість води є визначальною в формуванні її високої розчинної здатності. Для прикладу розглянемо дисоціацію (розчинення) галіту NaCl. В кристалічній структурі галіту Na+ і Cl- іони знаходяться на віддалі 2,36 Å і енергія їх зв‘язку складає 585 кДж/моль. Внаслідок входження між ці іони молекул води ця сила зменшується в 80 раз і складає 7,45 кДж/моль. В 1 М розчині NaCl середня віддаль між іонами складає 10 Å і енергія взаємодії між ними складає 1,8 кДж/моль (в вакуумі вона б складала 138 кДж/моль).
| Віддаль між іонами | Сила взаємодії | |
| Галіт NaCl | 2,36 Å | 585 кДж/моль |
| 1 М розчин NaCl | 10Å | 1,8 кДж/моль |
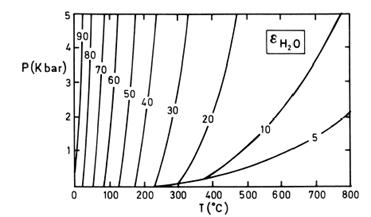
| Рис. 1 Залежнiсть дiелектричної сталої води вiд температури i тиску. |
Вплив температури і тиску на розчинну здатність води визначається наступними залежностями:
· Із ростом температури різко зменшується діелектрична стала води, що веде до зниження іонізації (рис.1).
· Тиск істотно впливає на діелектричну сталу води тільки при високих температурах і дещо підвищує її.
· Із ростом температури ростуть молекулярні вібрації, що підвищує іонізацію розчинених компонентів.
Окрiм цього на розчиннiсть впливає змiна констант дисоцiацiї iнших сполук в розчинi, перш за все фонових електролiтiв, якi дають лiганди для формування комплексiв (NaCl, HCl, H2S, CaCl2, NaHCO3i iншi). Абсолютна величина змiни констант дисоцiацiї в залежностi вiд температури i тиску складає 1-6 порядкiв. Видiляються двi групи електролiтiв в залежностi вiд змiни константи дисоцiацiї при зниженнi тиску i температури (пiдйомi до поверхнi Землi) (Рыженко, 1981):
- iз зростанням дисоцiацiї ("сильнi" при 25°С i 1 бар) (NaCl, HCl, H2SO4)
- iз зменшенням дисоцiацiї ("слабкi" при 25°С i 1 бар ) (CaOH2, MgOH2, H2CO3)
- електролiти промiжної сили, для яких ефект впливу температури i тиску на дисоцiацiю виражений слабо (H2S)
По мiрi зростання температури i тиску в ходi природнього мiнералоутворення вiдбувається зближення констант дисоцiацiї речовин. Процес електролiтичної дисоцiацiї i комплексоутворення при пiдйомi гiдротермальних розчинiв iз глибини сприяє роздiленню пар елементiв (іонiв) по мiрi наближення до земної поверхнi.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 757; Нарушение авторских прав?; Мы поможем в написании вашей работы!