
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основні властивості мінералів
|
|
|
|
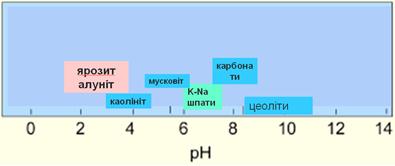
Мінеральні буфери pH
n 2KAlSi3O8 + 2H2O = Al2Si2O5(OH)4 + 2K+ + 2OH-
n 2Mg2SiO4 + 3H2O = Mg3Si2O5(OH)4 + Mg2+ + 2OH-
n CaCO3 + H2O = HCO3- + Ca2+ + OH-
Деякі мінерали є солями сильної основи і слабкої кислоти; їх розчинення призводить до зниження pH
¡ KFe3(SO4)2(OH)6 + 3H2O =
K+ + 3Fe(OH)3 + 2SO42- + 3 H+
Визначну роль в мiнералоутвореннi вiдiграють мiнеральнi буфери кислотностi в природнiх умовах:
- карбонатний
- польовошпатово-слюдяний
- слюдяно-каолiнiтовий
- хлоритно-польовошпатовий
Цi буфернi пари пiдтримують значення pH розчину, що рiвноважний цим мiнералам в вузькому iнтервалi значень. Буфер зпрацьовує до тих пiр, поки присутнi обидвi буфернi пари. Пiсля зникнення одного мiнералу, pH розчину починає змiнюватись, реагуючи на процеси, зовнiшнi, повiдношенню до системи мiнеральний буфер-розчин.
Таким же буфером може служити сумiш магнезиту i брукiту в рiвновазi iз розчином. Як видно iз рисунку, значення pH при наявностi магнезиту i брукiту не залежить вiд вмiсту Mg2+ та парцiального тиску CO2 в розчинi i буде залишатись стабiльним коло 11 од. pH до тих пiр, поки один iз мiнералiв не зникне iз системи.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 342; Нарушение авторских прав?; Мы поможем в написании вашей работы!