
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Діаграми Eh-pH
|
|
|
|
 а. а.
|  б. б.
|
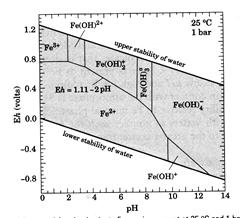
| Рис. 8.8. Діаграми E h -pH для сполук феруму в різних системах при Т=25°С, Р=1 бар (моляльність розчину 10-6).. Лінії вказують рівні активності іонів чи рівні кількості мінералів у розчині. Реакції, що не залежать від pH показані вертикальними лініями; реакції: що не залежать від Eh – горизонтальними. Похилі лінії відображають реакції, залежні від обох параметрів. На діаграмі А показані поля стабільності основних розчинних сполук феруму. На діаграмах б і в показані ускладнені системи, в яких появляються мінеральні фази карбонатів і сульфідів, відповідно. |  в. в.
|

| Рис. 8.9. Еh-pH діаграма для системи Mn-O-H. В межах поля стабільності води Mn приймає валентності +2, +3, +4. три валентні стани: пірохроїт Mn(OH)2 (+2), гаусманіт Mn3O4 (+2, +3), Mn2O3 (+3) і піролюзит MnO2 (+4). Широке поле займає Mn2+-іон. Мінеральні фази кристалізуються лише в лужних розчинах, і поля стабільності різних мінералів розширюються при зростанні Еh. Всі сполуки є метастабільні і прогресивно перетворюються у MnO2. Додавання до системи вуглецю та сірки (рисунок В, моляльність розчину = 10-3) призводить до появи родохрозиту MnCO3 і алабандиту MnS, що стабільні у відновно-лужних умовах. |

| Рис. 8.10. Еh-pH діаграма систем Cu-O-H і Cu-O-H – С - S (моляльність розчину = 10-6). В межах поля стабільності води мідь приймає валентності 0, +1, +2. В кислих розчинах, самородна мідь окиснюється до Cu2+, в лужних розчинах, при зростанні Еh, формуються тенорит CuO і куприт Cu2O. Розчинний компонент CuO22- є стабільним в сильно лужних умовах. При додаванні до системи вуглецю та сірки (рисунок В, моляльність розчину = 10-3) поле самородної міді скорочується, з’являються халькозин Cu2S і ковелін CuS. При високих Eh малахіт Cu2(OH)2CO3 заміщує тенорит. |
Аналогічні діаграми ми можемо розрахувати для інших важливих геохімічних систем.
Рис. 8.12.Еh-рН діаграма для головних аніонних лігандів. Карбон (А) існує в природі в трьох окисних станах (4+, 0, 4-). Вугільна кислота та її продукти іонізації знаходяться у більшій частині Еh-рН поля стабільності води. При рН вище, ніж 6,4, гідрокарбонат
для головних аніонних лігандів. Карбон (А) існує в природі в трьох окисних станах (4+, 0, 4-). Вугільна кислота та її продукти іонізації знаходяться у більшій частині Еh-рН поля стабільності води. При рН вище, ніж 6,4, гідрокарбонат
- іон переважає, при рН, вищих, ніж 10,3 переважає карбонат-іон СО32-. Самородний С стабільний при відновних умовах у дуже обмеженому полі Еh, нижче котрого знаходиться водний метан CH4(aq). Розвиток газу метану відбувається при відновних умовах відповідно до нижчого ліміту стабільності води (r).
В) Еh-pH діаграма азоту, розрахована для f N2=0,8 бар. Газова молекула N2 стабільна більшій частині поля. іон амонію NH4+ переважає у відновних умовах, нітрат іон NO3- у окисних. Газ амонію існує в дуже відновних і лужних умовах. Поле амонію і нітрат-іону протягується метастабільно в межі поля стабільності газу N2.
Обмеження переважання двох компонентів протягується у вигляді заштрихованої лінії всередині поля N2.
C) Еh-pH діаграма фосфору.всередині поля стабільності води, фосфор знаходиться у вигляді ортофосфорної кислоти H3PO4 та продуктів її іонізації. Головні обмеження диктуються кислотністю розчину і не залежать від відновних умов.
D) сірка представлена у водному розчині у трьох окисних станах (2-, 0, 6+). Поле самородної сірки дуже мале і співставиме з полем вуглецю. Сульфідний комплекс є в нижній частині діаграми. Перехід сульфід-сульфат вимагає значні затрати енергії і визначає ліміт переважання, над котрим існують сульфати. Поля протяжності самородних елементів (S, C) залежать від встановленої моляльності розчину (розширюються при зростанні та скорочуються при зменшенні моляльної концентрації). Моляльні концентрації, що використані при побудові діаграм, є середніми для природних вод.
| 
|
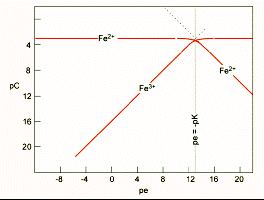
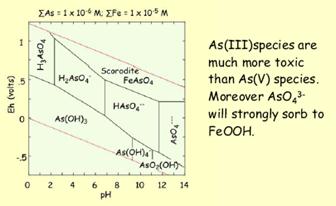
| Рис. Розрахунок точки рівних концентрацій Fe2+ і Fe3+ за відомою константою рівноваги. | Рис. 8.11. Діаграма E h -pH для сполук арсену. Зверніть увагу на зміну токсичності сполук. n сполуки As(III) є набагато більш токсичні, ніж сполуки As(V) species. n AsO43- активно сорбується на поверхні FeOOH |

Висновки
Окисно-відновні реакції (редокс-реакції) відбуваються шляхом перенесення електронів між сполуками. Ці реакції фіксуються за напругою між анодом і катодом. Напруга зв’язана із зміною вільної енергії Ґібса в цій реакції. Пів-реакції, що спостерігаються на аноді і катоді, відповідно, розглядаються окремо. Eh – напруга пів реакції, нормована за напругою на водневому електроді. Eh визначається за рівнянням Нернста.
Показником окисно-відновних умов може бути і p e - від’ємний логарифм активності лектронів у пів реакції.
У природних водах головним окиснювачем є кисень O2, а головним відновником – органічна речовина. Редокс-потенціал води контролюється вмістом органічної речовини і взаємодією води із повітрям. Важливу роль в контролі редокс-потенціалу відіграють бактерії.
Редокс-реакції у воді звичайно залежать від pH. Стабільність редокс-чутливих сполук в розчині можна зобразити на Eh-pH діаграмах. Варіації параметрів на цій діаграмі обмежені полем стабільності води. Eh-pH діаграми широко використовуються при вивченні гіпергенних процесів.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 578; Нарушение авторских прав?; Мы поможем в написании вашей работы!