
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тримолекулярные реакции в газовой фазе
|
|
|
|
Известны четыре реакции в газовой фазе с участием моноксида азота, кинетически являющиеся процессами третьего порядка:
2NO + O2 ® 2NO2
2NO + Cl2 ® 2NOCl
2NO + Br2 ® 2NOBr
2NO + H2 ® H2O + N2O
(или 2NO + 2H2 ® N2 + 2H2O)
Кроме этих процессов, тримолекулярными являются реакции рекомбинации валентно-ненасыщенных частиц
M + R¢ + R¢¢ ® R¢R¢¢ + M,
где М – любая частица, R – атом со свободной валентностью или радикал.
Для тримолекулярной рекомбинации характерно, что третья частица не принимает непосредственно участия в химическом процессе, стехиометрически являющемся бимолекулярным:
R¢ + R¢¢ ® R¢R¢¢,
а лишь способствует стабилизации, отводя избыточную энергию от молекулы R¢R¢¢.
Эффективность стабилизирующего тройного столкновения тем больше, чем больше атомов в молекуле третьей частицы М. Дело в том, что увеличение числа колебательных степеней свободы увеличивает вероятность отвода энергии от вновь образованной молекулы на межатомные связи молекулы М. Для атомных стабилизаторов (инертные газы) эффективность стабилизации растет с увеличением атомной массы.
Наиболее характерным для тримолекулярных реакций является их отрицательный температурный коэффициент. Закономерности, типа найденных Вант-Гоффом и Аррениусом, не соблюдаются. То же наблюдается и для рекомбинации: при рекомбинации атомного йода с увеличением температуры от 25 до 125оС константа рекомбинации уменьшается в 2-3 раза. Таким образом, первое, что надо объяснить при теоретическом истолковании тримолекулярных реакций, является аномальная температурная зависимость. Если подойти формально и использовать уравнение Аррениуса, то энергия активации получается отрицательной.
Первая попытка объяснений характерных особенностей тримолекулярных реакций принадлежит Траутцу, который рассматривал эти реакции как двустадийные процессы. Первая стадия равновесна и, например, для образования нитрозилхлорида заключается в присоединении обладающей неспаренным электроном молекулы NO к молекуле хлора
NO + Cl2 Û NOCl2
Поэтому
 , (8)
, (8)
где k 1 – константа скорости прямой реакции, а k 2 – константа скорости обратной реакции. Отсюда легко находим, что
 , (9)
, (9)
где K = k 1 / k 2 – константа равновесия.
Вторая, медленная стадия, определяющая скорость процесса в целом, является реакцией взаимодействия промежуточного соединения со второй молекулой NO

Следовательно, скорость реакции образования нитрозилхлорида будет равна
 (10)
(10)
Подставляя в это выражение значение концентрации NOCl2 из выражения (9), получим
 ,
,
то есть процесс является реакцией третьего порядка. По Траутцу, с ростом температуры равновесие сдвигается в сторону диссоциации промежуточного соединения типа NOCl2. Таким образом, скорость снижается с повышением температуры за счет уменьшения концентрации NOCl2. Наблюдаемая на опыте константа скорости есть произведение истинной бимолекулярной константы скорости на константу равновесия, уменьшение которой с ростом температуры и приводит к наблюдаемой аномальной зависимости k от Т и lg k от Т–1.
Рассмотрим, как могут быть объяснены тримолекулярные реакции по теории столкновений.
Число тройных соударений может быть найдено при условии, что известна длительность двойного соударения. Если считать молекулы идеально упругими шарами, то двойное столкновение мгновенно и участие в нем третьей частицы невозможно. Задача расчета числа тройных столкновений решается, если отказаться от представления о тройном столкновении как о моменте нахождения центра третьей молекулы на поверхности сферы, радиус которой равен сумме радиусов двух столкнувшихся молекул. Необходимо рассматривать конечную длительность пребывания центра малой молекулы в шаровом слое с радиусом, равным sАВ и sАВ + d (sАВ = r А + r В – сумма радиусов сталкивающихся молекул А и В). При этом d – величина неопределенная, что ограничивает возможность количественных расчетов.
Число тройных столкновений между молекулами трех различных видов в одном кубическом сантиметре в секунду равно
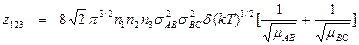 ,
,
где mАВ и mВС – приведенные массы молекул АВ и ВС.
Сравнивая выражение для тройных соударений с выражением для числа двойных соударений
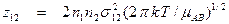 ,
,
нетрудно увидеть, что z123 отличается от z12 .
Для идеального газа число молекул в одном кубическом сантиметре равно n = p / k T. Следовательно, число тройных столкновений пропорционально кубу, а двойных – квадрату давления. При малых и средних давлениях число двойных столкновений значительно превышает число тройных, однако с повышением давления это соотношение изменяется в пользу тройных столкновений. Факт относительного роста числа тройных столкновений важен для истолкования многих химических процессов, идущих с помощью тройных столкновений, в том числе для объяснения предельных явлений при взрывах.
Константа скорости тримолекулярной реакции может быть легко найдена умножением величины z123 на аррениусовский экспоненциальный множитель
 (11)
(11)
Однако результаты расчета по этому уравнению не согласуются с опытными.
Из выражения (11) вытекает, что если величина z123 постоянна, то константа скорости должна увеличиваться с ростом температуры. Но выше было сказано, что константа скорости тримолекулярных реакций уменьшается с ростом температуры. Кроме того, в величину z123 входит неопределенный множитель d, что сильно затрудняет расчеты.
Множитель d для неидеальных систем должен зависеть от температуры, так как с изменением температуры меняется кинетическая энергия сталкивающихся частиц, а следовательно, и энергия их взаимодействия. Изменение энергии взаимодействия может быть учтено поправкой Сезерленда, то есть можно положить, что
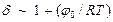 ,
,
где j0 – постоянная, связанная с энергией взаимодействия. Тогда

Поэтому для неидеальных систем
 (12)
(12)
Из выражения (12) после логарифмирования и дифференцирования по Т получаем
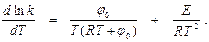
Это уравнение дает кривую зависимости k от Т–1, качественно совпадающую с кривой для тримолекулярных реакций (рис. 9, а). Однако неопределенность величины j0 делает количественные выводы весьма ненадежными. В связи с этим многие исследователи ограничиваются эмпирическими зависимостями константы скорости от температуры. Например, для реакции 2NO + Cl2 эмпирическая зависимость константы скорости от температуры имеет вид
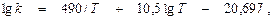
а для реакции 2NO + H2

Основной трудностью применения теории активированного комплекса к тримолекулярным реакциям является отсутствие сведений о составе и структуре переходного состояния. Обычно принимают, что активированный комплекс состоит из трех молекул, принимающих участие в реакции согласно стехиометрическому уравнению. Структура активированного комплекса значительно более упорядочена по сравнению с исходным состоянием, и энтропия активации должна быть существенно более отрицательной.
В теории активированного комплекса можно показать, что скорость тримолекулярной реакции действительно должна весьма заметно уменьшаться с ростом температуры (константа скорости обратно пропорциональна Т1/2) при условии, что энергия активации имеет конечную величину и в соответствии с ее физическим смыслом положительна. Таким образом, теория активированного комплекса дает качественное объяснение экспериментальной температурной зависимости тримолекулярной реакции. Далее оказывается возможным по опытным данным провести расчет истинной энергии активации тримолекулярного процесса.
Для реакции окисления NO получается, что энергия активации равна нулю.
Несмотря на ряд произвольных допущений, теория активированного комплекса разрешает основные теоретические трудности, возникающие при рассмотрении тримолекулярных реакций, и позволяет значительно детальней описать процесс, чем это было возможно в рамках теории столкновений. Заметим еще, что, по-видимому, неслучайно тримолекулярные реакции обычно идут с участием радикалов. Молекула NO, имеющая неспаренный электрон, может рассматриваться как радикал. Наличие свободной валентности приводит (в результате взаимодействия во время столкновения) к увеличению времени жизни сталкивающихся пар и, следовательно, к увеличению числа тройных столкновений. Последнее обстоятельство увеличивает вероятность образования тримолекулярных комплексов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 967; Нарушение авторских прав?; Мы поможем в написании вашей работы!